配位滴定法
發(fā)布時間:2017-07-22 瀏覽次數(shù):3827
配位滴定法是以配位反應(yīng)為基礎(chǔ)的一種滴定分析方法,又稱為絡(luò)合滴定法。根據(jù)路易斯酸堿理論,配位反應(yīng)也屬于酸堿反應(yīng),因此與酸堿滴定法有許多相似之處,但是配位滴定法更加復雜。配位滴定法主要用于金屬離子含量的測定,通過間接滴定、返滴定和置換滴定也可以測定許多陰離子和有機化合物,在食品檢測、生物制品分析、環(huán)境監(jiān)測、臨床檢驗等方面應(yīng)用廣泛。
配位滴定法中常用的滴定劑包括兩大類:一類是無機配位劑,另一類是有機配位劑。無機配位劑如NH3、F一、Cl一等,很少用于滴定分析,因為配位劑和金屬離子是逐級配位,且不太穩(wěn)定,所以不適合作為滴定劑;而作為滴定劑的僅有以CN一為滴定劑的氰量法和以Hg2+為中心離子的汞量法具有實際意義。
氰量法主要用于滴定Ag+,以KCN作為滴定劑,滴定反應(yīng)為:
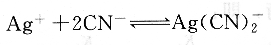
汞量法主要用于滴定Cl一和SCN一,以Hg(N03)2作為滴定劑,二苯氨基脲作指示劑,滴定反應(yīng)為
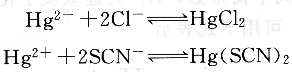
大多數(shù)有機配位劑常含有2個或2個以上的配位原子,與金屬離子配位時形成具有環(huán)狀結(jié)構(gòu)的螯合物,穩(wěn)定性好。其中廣泛用作配位劑的是含有氨羧基團[一N(CH2C00H)2]的一類有機化合物,稱為氨羧配位劑。這類配位劑中含有配位能力很強的氨氮和羧氧配位原子:

這兩種配位原子能與大多數(shù)金屬離子形成穩(wěn)定的配合物。氨羧配位劑的種類很多,其中應(yīng)用最廣的是乙二胺四乙酸,簡稱EDTA。EDTA可以直接或間接滴定幾十種金屬離子,是應(yīng)用最為廣泛的螯合劑。本章主要討論以EDTA為配位劑滴定金屬離子的配位滴定法,又稱為EDTA配位滴定法。
EDTA及其配合物的穩(wěn)定性:
1、EDTA的性質(zhì)
乙二胺四乙酸(ethylene diamine tetraacetic acid,簡稱EDTA或EDTA酸)為白色晶體,分子中含有4個可解離的H+,用H4Y表示。EDTA在水中的溶解度很小(220C時,100mL水中僅能溶解0.02g),難溶于酸和有機溶劑,易溶于堿。故通常用其二鈉鹽,一般簡稱EDTA或EDTA二鈉鹽,用Na2H2Y·2H20表示。EDTA二鈉鹽為白色晶狀化合物,在水中的溶解度較大(220C時,100mL水中可溶解11.1g),其溶液的濃度約為0.3m01·L-1 ,pH約為4.5。
EDTA的結(jié)構(gòu)式為:
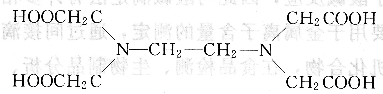
由于兩個氨氮上都有一對孤對電子,且電負性較大,因此EDTA在固態(tài)時,兩個羧基上的H+轉(zhuǎn)移到N原子上,形成雙偶極離子:
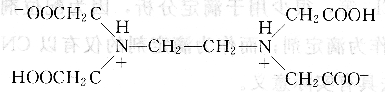
H4Y在強酸性介質(zhì)中,兩個羧基可以再接受H+,形成相當于六元酸的結(jié)構(gòu),以H6 Y2+表示,存在六級解離平衡,即:
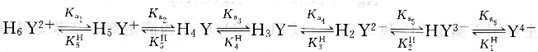
式中,Kai為EDTA的逐級解離平衡常數(shù);KHi為逐級質(zhì)子化常數(shù),也可稱為逐級穩(wěn)定常數(shù)。
逐級累積穩(wěn)定常數(shù)用βi表示,可用下式表示:
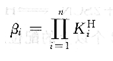
最后一級累積穩(wěn)定常數(shù)脅又稱為穩(wěn)定常數(shù)。EDTA的各種平衡常數(shù)之間的關(guān)系見表。
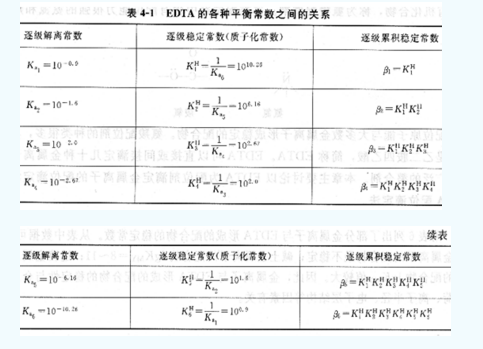
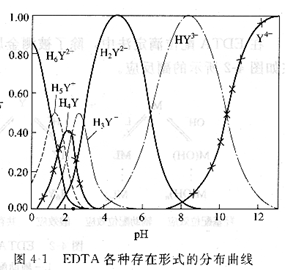
因此,在EDTA水溶液中,有H6 Y2+、H5Y+、H4Y、H3Y-、H2Y2-、HY3-和Y4-七種形式同時存在,各種存在形式的分布系數(shù)與pH有關(guān)。
從圖可以看出,不論EDTA的原始存在形式是H4Y還是Na2H2Y,在pH<1的強酸性溶液中,EDTA主要以H6Y2+形式存在;在pH=1~1.6的溶液中,主要以H5Y+形式存在;在pH=1.6~2.0的溶液中,主要以H4Y形式存在;在pH=2.O~2.67的溶液中,主要以H3 Y-形式存在;在pH=2.67~6.16的溶液中,主要以H2Y2一形式存在;在pH=6.16~10.26的溶液中,主要以Y4一形式存在。
2、EDTA的螯合物
EDTA與金屬離子形成螯合物時,它的兩個氨基氮和四個羧基氧都能與金屬離子鍵合,形成配位數(shù)為4或6的穩(wěn)定的配合物。EDTA與金屬離子的配位反應(yīng)具有如下特點。
①EDTA與許多金屬離子可形成配位比為1:1的穩(wěn)定配合物。例如:
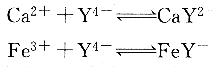
只有極少數(shù)高氧化值金屬離子與EDTA螯合時,不是形成1:1的配合物,例如.Mo(Ⅵ)、Zr(Ⅳ)等。
②EDTA與多數(shù)金屬離子生成含多個五元環(huán)的螯合物,具有很高的穩(wěn)定性。具有五元環(huán)或六元環(huán)的螯合物很穩(wěn)定,而且所形成的環(huán)愈多,螯合物愈穩(wěn)定。
③EDTA與金屬離子形成的配合物大多易溶于水,反應(yīng)速率較快。
④EDTA與無色金屬離子生成的配合物為無色,與有色金屬離子一般生成顏色更深的配合物。滴定時,如果遇到有色金屬離子,要注意控制溶液的濃度,以利于終點的判斷。EDTA(簡單表示為Y)與金屬離子的配位反應(yīng)可簡寫為:
M+Y=MY
反應(yīng)達到平衡時,其穩(wěn)定常數(shù)表達式為:
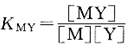
附表列出了部分金屬離子與EDTA形成的配合物的穩(wěn)定常數(shù)。從表中數(shù)據(jù)可以看出,堿金屬離子的配合物最不穩(wěn)定;堿土金屬離子的配合物lgKMY=8~11;過渡金屬、稀土元素的配合物lgKMY值較大。因此,金屬離子與EDTA形成的配合物的穩(wěn)定性與金屬離子的電荷、離子半徑、電子層結(jié)構(gòu)等因素有關(guān)。
參考資料:分析化學
 |
 |
| 上一條:喬科化學開展危化品安全管理培訓 | 下一條:間接原子吸收光譜法測定氯化物 |
相關(guān)新聞
- 1、1-甲基苯唑、10328-92-4 CAS查詢、1-甲基苯唑物化性質(zhì)
- 2、2,3-二氯苯基乙酸甲酯、10328-87-7 CAS查詢、2,3-二氯苯基乙酸甲酯物化性質(zhì)
- 3、3-溴-4-(叔丁基)苯胺、103275-21-4 CAS查詢、3-溴-4-(叔丁基)苯胺物化性質(zhì)
- 4、微膠囊化紅磷、103271-45-5 CAS查詢、微膠囊化紅磷物化性質(zhì)
- 5、2-溴-4-叔丁基苯胺、103273-01-4 CAS查詢、2-溴-4-叔丁基苯胺物化性質(zhì)
- 6、S-三唑,3,5-二氯-、10327-87-4 CAS查詢、S-三唑,3,5-二氯-物化性質(zhì)





