重鉻酸鉀法
發布時間:2017-09-01
方法概述:
K2Cr207是常用的氧化劑之一,它具有較強的氧化性,在酸性介質中Cr2O2-7一被還原為Cr3+,其電極反應如下:
Cr202-7+14H++6e-=12Cr3++7H20
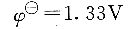
重鉻酸鉀的氧化能力不如高錳酸鉀強,因此重鉻酸鉀法可以測定的物質不如高錳酸鉀法廣泛,但與高錳酸鉀法相比,有其自己的優點。
①? K2Cr207易提純,符合基準物質的條件,在140~1500C干燥2h后,可直接稱量配制標準溶液。K2Cr2O7標準溶液相當穩定,保存在密閉容器中,濃度可長期保持不變。
②室溫下,當HCl溶液濃度低于3mol?L一1時,Cr202一7不會誘導氧化C1-,因此K2Cr207法可在鹽酸介質中進行滴定。
但是,Cr2O2-7的還原產物是Cr3+,呈綠色,滴定時須用指示劑指示滴定終點。常用的指示劑為二苯胺磺酸鈉。
(1)鐵礦石中全鐵量的測定
重鉻酸鉀法是測定礦石中全鐵量的標準方法。根據預氧化還原方法的不同分為SnCl2-HgCl2法和Sncl2-Ticl3(無汞測定法)。
① SbCl2-HgCl2法 試樣用熱濃HCl溶解,用SnCl2趁熱將FE3+。冷卻后,再用水稀釋,過量的SnCl2用HgCl2氧化。然后加入H2SO4-H3PO4混合酸和二苯胺磺酸鈉指示劑,立即用K2Cr2O7標準溶液滴定至溶液由淺綠(Cr3+)色變為紫紅色。滴定反應為:
Cr2O2-7+6Fe2+14H+=2Cr3++6Fe3++7H2O
測定中加入H3PO4的目的有兩個:一是為了降低Fe3+/Fe2+電對的電極電勢,使滴定突躍范圍增大,讓二苯胺磺酸鈉變色點的電勢值落在滴定的突躍范圍之內;二是為使滴定反應的產物Fe3+生成無色的 [Fe(PO4)2]3-,消除Fe3+黃色干擾,以利于滴定終點的觀察。
② 無汞測定法 樣品用酸溶解后,以SnCl2趁熱將大部分Fe3+還原為Fe2+,再以鎢酸鈉為指示劑,用TiCl3還原剩余的Fe3+,反應為
Fe3++Ti3+→Fe2++Ti4+
當Fe3+定量還原為Fe2+之后,稍過量的TiCl3即可使溶液中作為指示劑的氧化值為+6的W(VI)還原為藍色的氧化值為+5的W(V)鎢化合物(俗稱“鎢藍”),“鎢藍”的出現表示 已被完全還原。然后滴入重鉻酸鉀溶液,使鎢藍剛好褪色。最后以二苯胺橫酸鈉為指示劑,用K2Cr2O7標準溶液滴定溶液中的 Fe2+,即可求出全鐵含量。
(2)測定污水的化學耗氧量(CODcr)
用K2Cr2O7法測定的化學耗氧量用CODcr表示。CODcr是衡量污水被污染程度的重要指標,它是目前應用最為廣泛的方法。其測定原理是:
水樣中加入一定量的重鉻酸鉀標準溶液,在強酸性(H2SO4)條件下,以Ag2SO4為催化劑,加熱回流2h,使重鉻酸鉀與有機物和還原性物質充分作用。過量的重鉻酸鉀,用硫酸亞鐵銨標準溶液返滴定,以1,10-鄰二氮菲-亞鐵為指示劑。由所消耗的硫酸亞鐵銨標準溶液的量及加入水樣中的重鉻酸鉀標準溶液的量,便可計算出水樣中還原性物質消耗氧的量。
參考資料:分析化學







