定量分析化學概述(一)
發布時間:2017-09-01
一、定量分析過程
定量分析的主要任務是測定物質中某種或某些組分的含量。由于被測物種類繁多,性質各異,具體的測定方法和步驟自然不同,但是要完成一項定量分析工作,其分析過程通常是一樣的,即包括取樣、試樣的分解和分析試液的制備、干擾組分的分離、待測組分的測定、數據的計算和處理以及分析結果的報告和評價等步驟。
(一)取樣
從大量的分析對象中抽取一小部分作為分析材料的過程,稱為取樣。所取得的分析材料稱為試樣或樣品。取樣的關鍵首先是保證所取試樣具有高度的代表性,即用作分析的試樣應能代表被分析對象的平均組成;其次是在采樣的過程中,應嚴格防止雜質混入。取樣是分析過程中很重要的一個環節,取樣不正確,會導致錯誤結論,使定量分析失去意義。對于不同的分析對象和不同的狀態(氣體、液體和固體),試樣的采集方法各不相同。
1、氣體試樣的采取
對于氣體試樣,需按具體情況,采用相應的采取方法。例如大氣樣品的采取,通常選取距地面50~180cm的高度取樣,這樣取得的樣品與人們呼吸的空氣相同。對于煙道氣、廢氣中某些有毒污染物的分析,可將氣體樣品采入空瓶或大型注射器中。大氣污染物的測定通常是通過適當的吸收劑將被測氣體吸收濃縮,然后進行分析。
2、液體試樣的采集
對貯存在大容器中的液體,要從容器的不同深度取出適量樣品,然后均勻混合后作為分析試樣;而對分裝在小容器中的液體,則應從每一容器中取出適量樣品,均勻混合后作為分析試樣。
對流動的液體,應根據具體情況,采用不同的方法進行取樣。當采取水管中或有泵抽的水井中的水樣時,取樣前需將水龍頭或泵打開,先放水10~15min,然后再用干凈瓶子收集水樣至滿瓶即可。采取江、河、湖中的水樣時,可將干凈的空瓶蓋上塞子,塞上系一根繩,瓶底系一鐵鉈或石頭,沉入離水面一定深處,然后拉繩拔塞,讓水流滿瓶后取出。如此操作,在不同深度取幾份水樣混合后,作為分析試樣。
又如油脂的采樣方法,按不同的貯存方式,使用的采樣器不同,即采樣方法不同。可分為桶裝采樣法和散裝采樣法。桶裝采樣法中,根據桶裝油總件數確定采樣數量,采樣前需將油脂攪拌均勻,再將采樣管緩慢地由桶口斜插至桶底取樣。散裝采樣法中,采樣數量與散裝油脂總量有關;采用規則,按散裝油高度,等距離地分為上、中、下三層采樣。具體采樣數量及采樣方法見國標GB/T 5524―85。
在采取氣體或液體試樣前,必須先把容器及通路洗滌干凈,再用要采取的氣體或液體沖洗數次或使之干燥,然后取樣,以免混入雜質。
3、固體試樣的采集
固體試樣種類繁多,經常遇到的有礦石、合金、鹽類和谷物等。不同的固體,采樣方法不同,大多都有國家標準。下面簡要介紹不同固體試樣的采集和制備。
(1)礦石試樣
在取樣時要根據原料的堆放情況,從不同的部位和深度選取多個取樣點。采取的份數越多越有代表性。但取樣點太多,需要耗費大量的時間和人力。采集多少樣品才算合適呢?根據經驗,應取試樣的量與實驗結果要求的精密度、試樣的不均性和粒度有關。通常試樣的采取可按下面的經驗公式(亦稱采樣公式)計算:
Q≥Kda
式中,Q為采取試樣的最低質量,kg;d為試樣中最大顆粒直徑,mm;K和a為經驗常數,根據物料的均勻程度和易破碎程度等而定。通常K值在0.02~1之間,a值為1.8~2.5。
地質部門把a值規定為2,則上式為:
Q≥Kd2
由此可知,礦石顆粒越大,采取的試樣量越多。在采集赤鐵礦試樣時,若赤鐵礦的K值為O.06,最大顆粒直徑為20mm,則應取礦樣的最小量為:
Q=0.06 X 202=24(kg) 。
顯然所取的原始試樣不僅量大,而且組成、顆粒大小都很不均勻,過制備,才能得到高度均勻的分析試樣制備試樣分為破碎、過篩、混勻和縮分四個步驟。
大塊礦樣先用壓碎機破碎成小的顆粒,再進行縮分。常用的縮分方法為“四分法”(圖1-1)。
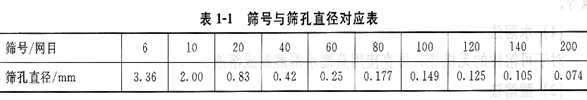
將試樣粉碎之后混合均勻,堆成錐形,然后再壓成臺形,從錐心四等分,去掉對角兩份后再堆錐,這樣試樣便縮減了一半,稱為縮分一次。每次縮分后的最低質量應符合采樣公式的要求,如果縮分后試樣的質量大于按計算公式算得的質量,則可連續進行縮分直至所剩試樣稍大于或等于最低質量為止。然后再進行粉碎、縮分,最后制成100~300g左右的分析試樣,裝入瓶中,貼上標簽供分析之用。各種篩號的篩孔規格如表1―1所示。
(2)金屬或金屬制品
由于金屬經過高溫熔煉,組成比較均勻,因此,對于片狀或絲狀試樣,剪取一部分即可進行分析。但對于鋼錠和鑄鐵,由于表面和內部的凝固時間不同,鐵和雜質的凝固溫度也不一樣,因此,表面和內部的組成是不很均勻的。取樣時應先將表面清理,然后用鋼鉆在不同部位、不同深度鉆取碎屑混合均勻,作為分析試樣。
(3)粉狀或松散物料試樣
常見的粉狀或松散物料有鹽類、化肥、農藥、精礦和谷物等,其組成比較均勻,因此取樣點可少一些,每點所取之量也不必太多。各點所取試樣混勻即可作為分析樣品。一般情況來說,準確度要求愈高,采樣量愈大。物料愈不均勻,采取量愈多。
(4)濕存水的處理
一般固體試樣往往含有濕存水。試樣表面及孔隙中吸附的空氣中的水分稱為濕存水(亦稱吸濕水)。由于濕存水含量隨試樣粉碎程度和放置時間而改變,因而試樣各組分的相對含量也隨濕存水的多少而變化。為了便于比較,試樣中各組分相對含量常以干基表示。干基是不含濕存水的試樣的質量。因此,在進行分析之前,先將試樣烘干,去除濕存水。濕存水的含量,可根據烘干前后試樣的質量來計算。
二、試樣的分解和分析試液的制備
在實際分析工作中,除干法分析(如紅外光譜分析、差熱分析等)外,化學分析法往往是在溶液中進行測定(也叫濕法分析)。因此,對可溶性試樣要進行溶解,對難溶性試樣要進行分解,使試樣中以各種形態存在的被測組分都轉入溶液并呈可測定的狀態。試樣經溶解或分解后所得溶液,稱為試液。在溶解或分解試樣時,應根據試樣的化學性質采用適當的處理方法,不僅要考慮對準確度和測定速率的影響,而且要求分解后被測組分的測定和雜質的分離都要易于進行。在分解試樣的過程中,應遵循以下幾個原則:①試樣的分解必須完全。使被測組分全部轉入試液;②在分解試樣的過程中,待測組分不能有損失;③不能引入待測組分和干擾物質。
根據試樣的性質和測定方法的不同,常用的分解方法有溶解法、熔融法和干式灰化法等。
1、溶解法
采用適當的溶劑,將試樣溶解后制成溶液的方法,稱為溶解法。常用的溶劑有水、酸和堿等。
(1)水溶法
對于可溶性的無機鹽,可直接用蒸餾水溶解制成溶液。
(2)酸溶法
常用無機酸作為溶解試樣的溶劑。酸溶法是利用這些酸的酸性、氧化還原性及配位性,使被測組分轉入溶液。常用的酸有以下幾種。
①? HCl 鹽酸是分解試樣的重要強酸之一,電極電勢順序在氫之前的金屬及大多數金屬氧化物和碳酸鹽都可溶于鹽酸中;另外,Cl-具有一定的還原性,并且還可與很多金屬離子生成配離子而利于試樣的溶解,常用來溶解赤鐵礦(Fe203)、輝銻礦(Sb2S3)、碳酸鹽、軟錳礦(Mn02)等試樣。
②HN03 硝酸具有較強的氧化性,除鉑、金和某些稀有金屬外,濃硝酸幾乎能溶解所有的金屬及其合金。鐵、鋁、鉻等會被硝酸鈍化,溶解時加入非氧化酸(如鹽酸),以除去金屬表面致密的氧化膜,即可很好地被溶解。幾乎所有的硫化物也都可被硝酸溶解,但應先加入鹽酸,使硫以H2S的形式揮發出去,以免單質硫將試樣裹包,影響分解。
③H2SO4 除鈣、鍶、鋇、鉛的硫酸鹽外,其他金屬的硫酸鹽都溶于水。熱的濃硫酸具有很強的氧化性和脫水性,常用于分解鐵、鈷、鎳等金屬和鋁、鈹、銻、錳、釷、鈾、鈦等金屬合金以及分解土壤等樣品中的有機物等。硫酸的沸點較高(338℃),當硝酸、鹽酸、氫氟酸等低沸點酸的陰離子對測定有干擾時,常加硫酸并蒸發至冒白煙(SO3)來驅除。
④H3PO4 磷酸是中強酸,具有很強的配位能力,幾乎90%的礦石都能溶于磷酸。包括許多其他酸不溶的鉻鐵礦、鈦鐵礦、鈮鐵礦、金紅石等,對于含有高碳、高鉻、高鎢的合金也能很好地溶解。單獨使用磷酸溶解時,一般應控制在500~600℃,時問5min以內。若溫度過高、時問過長,會析出焦磷酸鹽難溶物,并生成聚硅磷酸黏結于器皿底部,同時也腐蝕了玻璃。
⑤HCl04 熱的濃高氯酸具有很強的氧化性,能迅速溶解鋼鐵和各種鋁合金。能將Cr、V、S等元素氧化成最高氧化值。高氯酸的沸點為203℃,蒸發至冒煙時,可驅除低沸點的酸,殘渣易溶于水。高氯酸也常作為重量法中測定SiO2的脫水劑。使用HCl04時,應避免與有機物接觸,以免發生爆炸。
⑥HF 氫氟酸的酸性很弱,但F-的配位能力很強,氫氟酸主要用來分解硅酸鹽和含硅化合物,生成揮發性的SiF4而逸出。分解試樣時常與硫酸混合使用。
⑦混合酸溶法 混合酸具有比單一酸更強的氧化能力。常用的混合酸有:王水,H2S04+HCl04,HF+HN03,HF+H2S04,H2S04+H3P04,HCl+HN03+HCl04,HN03+H2S04+HCl04(少量)等。如單一酸不能溶解的HgS,可以溶解于王水中。
參考資料:分析化學







