非水溶液的酸堿滴定(一)
發布時間:2017-09-01
酸堿滴定一般都在水溶液中進行。但是許多有機試樣難溶于水;許多弱酸、弱堿,當它們的離解常數小于10-8時,在水溶液中不能直接滴定;另外,一些酸(或堿)的混合溶液在水溶液中不能分別滴定,因此在水溶液中進行的酸堿滴定有一定局限性,若采用非水滴定就可以克服上述困難,擴大酸堿滴定的應用范圍。
一、非水滴定中的溶劑
1、溶劑的分類
根據酸堿質子理論,可將非水溶劑分為質子溶劑和非質子溶劑兩大類。
(1)質子溶劑
能給出質子或接受質子的溶劑,稱為質子溶劑。其最大特點是在溶劑分子問有質子轉移,能發生質子自遞反應。根據它們酸堿性的強弱,又分為以下3類。
①兩性溶劑:既易給出質子又易接受質子的溶劑,又稱為中性溶劑。其酸堿性與水相似。醇類一般屬于兩性溶劑,如甲醇、乙醇、丙醇、乙二醇等。兩性溶劑適用于滴定不太弱的酸、堿的介質。
②酸性溶劑:給出質子的能力較強的溶劑,如甲酸、醋酸、丙酸等,酸性溶劑適于作為滴定弱堿性物質的介質。
③堿性溶劑:接受質子的能力較強的溶劑,如乙二胺、丁胺、乙醇胺等,堿性溶劑適于作為滴定弱酸性物質的介質。
(2)非質子溶劑
非質子溶劑的特點是沒有給出質子的能力,分子問沒有質子的轉移,不能發生分子的自遞反應。但是這類溶劑可能具有接受質子的能力,根據溶劑接受質子能力的不同,可進一步將它們分為兩類。
①偶性親質子溶劑:溶劑分子中無轉移性質子,但卻有較弱的接受質子傾向和形成氫鍵的能力,如酮類、酰胺類、吡啶類、脂類等。這類溶劑具有一定堿性卻無酸性,適合作為弱酸的滴定介質。
②惰性溶劑:溶劑分子幾乎沒有接受質子的能力。不參與酸堿反應,也無形成氫鍵的能力,但能起溶解、分散和稀釋溶質的作用,這種溶劑稱惰性溶劑,如苯、四氯化碳、氯仿、正己烷等。在惰性溶劑中,質子轉移反應直接發生在被滴物與滴定劑之間。
應當指出,溶劑的分類是一個比較復雜的問題,目前有多種不同的分類方法,但都各有其局限性。實際上,各類溶劑之間并無嚴格的界限。
(1)溶劑的解離性
除惰性溶劑外,非水溶劑均有不同程度的解離,存在下列平衡:
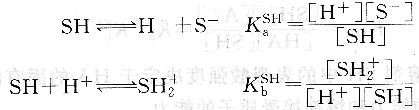
式中,KaSH為溶劑的固有酸度常數,反映溶劑給出質子的能力;KaSH為溶劑的固有堿度常數,反映溶劑接受質子的能力。
溶劑的自遞反應為:2SH?sH2++S-
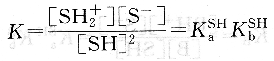
由于溶劑自身解離極微,且溶劑是大量的,故[SH]可看作是定值,則得:
Ks=[SH2+][S-]=KaSHK[SH]2
式中,Ka稱為溶劑的自身離解常數或離子積。如乙醇的質子自遞反應為:
2C2H50H?C2H50H2++C2H50-
則質子自遞常數Ks=[C2 H5 OH2+][C2 H5 0-]=7.9×1-20加,而水的質子自遞常數Ks=[H30+][OH-]=1.0×10-14。
在一定溫度下,不同溶劑因其解離程度不同而具有不同的質子自遞常數。溶劑質子自遞常數Ks值的大小對滴定突躍范圍有一定的影響。溶劑的自身離解常數越小,突躍范圍越大,滴定終點越敏銳。下面以水和乙醇兩種溶劑進行比較。
在水溶液中,以O.1m01?L-1的NaOH溶液滴定同濃度的一元強酸,當滴定至化學計量點前O.1%時,pH=4.3;化學計量點后0.1%時,pOH=4.3,pH=14―4.3=9.7,滴定突躍范圍為4.3~9.7,有5.4個pH單位的變化。
在乙醇溶劑中,C2 H5 OH2+相當于水中的H3 O+,C2 H5 O-相當于0H-。若以O.1mol?L-1C2H50Na溶液滴定酸,當滴定到化學計量點前O.1%時,pH*=4.3(這里pH*代表pC2 H5 OH2)。而滴定至化學計量點后0.1%時,pC2 H5 0=4.3,因為pC2H50H2+pC2H50=19.1,此時pH*=19.1―4.3=14.8。故在乙醇溶液中pH+的變化范圍為4.3~14.8,有10.5個pH+單位的變化,比水為介質的溶液突躍范圍大得多。由此可見,溶劑的自身離解常數越小,突躍范圍越大,滴定終點越敏銳。因此,原來在水中不能滴定的酸堿,在乙醇中有可能被滴定。
(2)溶劑的酸堿性
溶劑的酸堿性對溶質酸堿性強弱有影響。若用HA代表酸或B代表堿,根據質子理論有下列解離平衡存在:
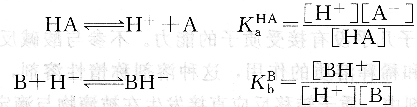
若將HA溶于質子溶劑sH中,則發生下列質子轉移反應:
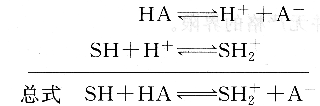
反應平衡常數,即溶質HA在溶劑SH中的表觀解離常數為:
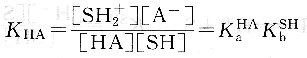
上式表明,酸HA在溶劑sH中的表觀酸強度決定于HA的固有酸度和溶劑SH的堿度。即決定于酸給出質子的能力和溶劑接受質子的能力。同理,堿B溶于質子溶劑SH中,則發生下列質子轉移反應:
SH+B?BH++S-
反應平衡常數KB為:
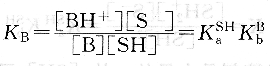
堿B在溶劑SH中的表觀堿強度決定于B的固有堿度和溶劑SH的酸度。即決定于堿接受質子的能力和溶劑給出質子的能力。
由此可見,酸、堿的強度不僅與酸、堿自身給出、接受質子的能力有關,而且還與溶劑的接受、給出質子的能力有關。在非水滴定中,對于弱酸性物質,應選擇堿性溶劑,使物質的酸性增加;對于弱堿性物質,應選擇酸性溶劑,使物質的堿性增加。
參考資料:分析化學







