首頁(yè)>技術(shù)中心>技術(shù)資訊>電分析化學(xué)法(二)
電分析化學(xué)法(二)
發(fā)布時(shí)間:2017-09-01
(2)晶體膜電極
難溶鹽固體膜電極是應(yīng)用最廣泛的一種離子選擇性電極,其結(jié)構(gòu)一般如圖8.1(b)所示,傳感膜一般是用單晶片或沉淀鹽壓成片制成。難溶鹽固體膜電極又可分為單晶膜電極和多晶均相膜電極。
流動(dòng)載體電極(液膜電極)的傳感膜是由有機(jī)液體物質(zhì)組成,又可分為液體離子交換膜電極及中性載體電極。這些電極的傳感膜物質(zhì)與待測(cè)物質(zhì)有選擇性離子交換作用或形成穩(wěn)定配合物的作用。其結(jié)構(gòu)如圖8.1(c)所示。
金屬基電極分為以下幾類:
(1)第一類電極(活性金屬電極)
由金屬和該金屬的離子組成。例如金屬銀電極,將金屬銀絲插入到含Ag+的溶液中,銀電極的電位用下式表示:
![]()
用這類電極作工作電極可進(jìn)行與相應(yīng)金屬離子有關(guān)的沉淀滴定,例如,用AgNO3滴定Cr-時(shí),可用銀電極指示滴定過程中C1一濃度的變化。
(2)第二類電極(金屬/難溶鹽電極)
由金屬、該金屬的難溶鹽和該難溶鹽的陰離子溶液組成。如銀一氯化銀電極,其電極電位為:
![]()
當(dāng)ac1-一定時(shí)其電位是穩(wěn)定的,電極反應(yīng)是可逆的。
(3)第三類電極
由金屬與兩種有相同陰離子的難溶鹽(或難離解的配合物),再與含有第二種難溶鹽(或難離解的配合物)的陽(yáng)離子組成的電極系統(tǒng)。這種電極可在電位滴定中用作pM的工作電極。
(4)零類電極
由一種惰性金屬與含有可溶性的氧化態(tài)和還原態(tài)物質(zhì)的溶液組成。此類電極主要用于氧化還原滴定中作工作電極。
還有一些電極如氣敏電極、生物電極、離子敏感場(chǎng)效應(yīng)晶體管電極等也可用作電位分析的工作電極。
三、電解分析法的原理
各種不同的離子具有不同的還原電位,這是用電解法分離各種元素的基礎(chǔ)。實(shí)際分解電壓通常比理論計(jì)算的分解電壓大,這一方面是因?yàn)殡娊赓|(zhì)溶液有一定的電阻,電流通過時(shí)一部分電壓用于克服整個(gè)電路中的電位降;另一方面,還有一部分電壓用于克服極化現(xiàn)象產(chǎn)生的陽(yáng)極反應(yīng)和陰極反應(yīng)的過電位。因此,電解時(shí)為使反應(yīng)能順利進(jìn)行,對(duì)陰極反應(yīng)而言,必須使陰極電位比其平衡電位更負(fù);對(duì)陽(yáng)極反應(yīng)而言,則必須使陽(yáng)極電位比其平衡電位更正。電解過程中,在電極上析出的物質(zhì)的質(zhì)量與通過電解池的電量之間的關(guān)系遵守Faraday定律:
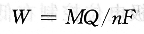
式中,w為在電極上析出的物質(zhì)的質(zhì)量,g;M為分子的摩爾質(zhì)量;n為電子轉(zhuǎn)移數(shù);F為Faraday常數(shù),1F=96487C;Q為電量,C。如果通過電解池的電流是恒定的,則:

根據(jù)Faraday定律,可用重量法、氣體體積法或其他方法測(cè)得電極上析出的物質(zhì)量,再求出通過電解池的電量;相反,測(cè)量通過電解池的電量,則可求算出電極上析出的物質(zhì)量。
電重量分析法不要求電流效率100%,但要求副反應(yīng)產(chǎn)物不沉積在電極上。庫(kù)侖分析則要求電流效率1O0%,即電極反應(yīng)按化學(xué)計(jì)量進(jìn)行,無副反應(yīng)。在常規(guī)分析中,電流效率不低于99.9%是允許的。
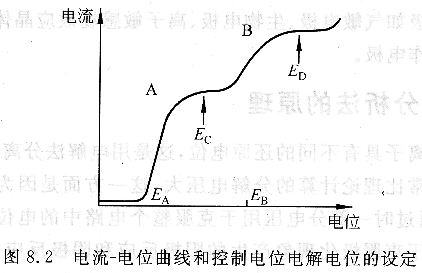
1、控制電位電解分析法
控制電位電解分析法中,最重要的是電解電位的選定。這可用電流一電位曲線來提供基本的參考信息,如圖8.2所示。圖中EA,EB分別表示A,B的半波電位,將電位選擇于Ec進(jìn)行電解,可選擇性地電解A而B不受干擾。但電解過程與溶液組成及電極材料、表面狀態(tài)等有關(guān)。大表面積的汞電極被廣泛用于控制陰極電位電解法,該法也稱汞陰極電解分析法。
為獲得良好的金屬析出物,不僅要考慮陰極的干擾問題,還要考慮陽(yáng)極的干擾問題。向溶液中加入“陽(yáng)極去極化劑”,可防止陽(yáng)極干擾。其作用原理是,它能夠在陽(yáng)極上優(yōu)先被氧化,使陽(yáng)極電位控制在低于發(fā)生干擾反應(yīng)的數(shù)值并保持穩(wěn)定不變,而且其氧化產(chǎn)物也不干擾金屬沉積。
2、庫(kù)侖分析法
根據(jù)法拉第定律,發(fā)生電極反應(yīng)的物質(zhì)的量與通過電解池的電量成正比。在庫(kù)侖分析中,只有當(dāng)電流效率為100%時(shí),即沒有其他副反應(yīng)或次級(jí)反應(yīng)存在,通過電解池的電量才完全用于待測(cè)物質(zhì)進(jìn)行的電極反應(yīng),因而才能進(jìn)行準(zhǔn)確定量分析。
按照進(jìn)行電解的方式不同,庫(kù)侖分析法可分為控制電位庫(kù)侖分析和恒電流庫(kù)侖分析(庫(kù)侖滴定)兩種。控制電位庫(kù)侖分析與上述控制陰極電位電解分析法類似,是使工作電極的電位保持恒定,使待測(cè)組分在該電極上發(fā)生定量的電解反應(yīng),當(dāng)電解電流降至零時(shí)電解完成。用庫(kù)侖計(jì)測(cè)定電解過程中所通過的電量,從而求得被測(cè)組分的含量。
恒電流庫(kù)侖法也稱為庫(kù)侖滴定法,可用于各種類型的容量滴定。但與容量滴定的不同之處是作為化學(xué)標(biāo)準(zhǔn)的滴定劑不是由標(biāo)準(zhǔn)物質(zhì)配制的,也不是由滴定管加入的,而是由恒定電流在試樣內(nèi)部電解產(chǎn)生的。因而庫(kù)侖滴定是一種不需要標(biāo)準(zhǔn)物質(zhì)的、以電子作滴定劑的容量分析。滴定時(shí)保持電解電流不變,選擇適當(dāng)?shù)闹甘窘K點(diǎn)的方法,記錄電解開始至終點(diǎn)的時(shí)間。
參考資料:現(xiàn)代儀器分析實(shí)驗(yàn)與技術(shù)







