電分析化學法(三)
發布時間:2017-09-01
四、極譜和伏安分析法原理
1、經典極譜法
極譜分析是一種在特殊條件下的電解形式,即體系在不加攪拌、工作電極處于高電流密度、高度濃差極化的條件下進行的電解(圖8.3)。它采用滴汞電極作工作電極,由于電極面積非常小,因而該電極上電流密度非常大。當滴汞電極上的電位由正向負掃描時,電極表面待測離子濃度迅速減小,直至變為零。這時雖然溶液本體中待測離子濃度不為零,但其從溶液本體中擴散至電極表面受擴散過程控制;電位再向負向增加,電流也不再增加,而達到一個恒定值,其大小由待測離子擴散的速度限制。只要待測離子一到達電極表面,它就立即被還原,因:
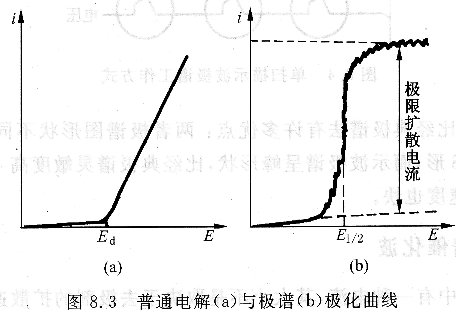
而陰極出現了濃差極化。此時電流到達一個極限值,稱為極限擴散電流,其大小與待測離子濃度相關。
經典極譜法中電壓的掃描速度慢、汞消耗量大、分析靈敏度及相鄰波的分辨率較低。在經典極譜法的基礎上提出的單掃描示波極譜、微分脈沖極譜以及各種極譜催化波方法,提高了極譜分析的靈敏度和選擇性,擴大了極譜方法的應用范圍,使極譜法成為微量分析的有用工具。
2、單掃描示波極譜法
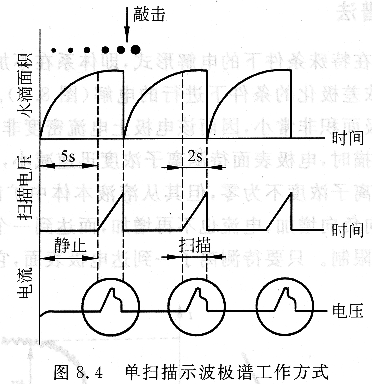
單掃描示波極譜由時間控制器控制每一滴汞的生長周期為7s。在7s周期結束時儀器發出一敲擊信號將汞滴擊落,新的一滴汞又開始生長。這樣可保證每次測定期間汞滴大小重現。由于汞滴生長周期的前5s內汞滴的表面積變化相對較大,電容充放電電流變化也比較大。示波極譜在這前5s期間電極上只加初始電位,在后2s期間以約250mV/s的速度快速掃描(見圖8.4),這樣電容電流可顯著降低。同時每一滴汞生長周期內加一次掃描電壓,在示波器上記錄一次電流一電位曲線,因此稱為單掃描示波極譜。
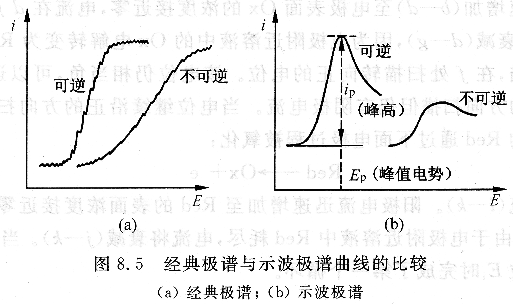
示波極譜法比經典極譜法有許多優點:兩者極譜圖形狀不同,如圖8.5所示,經典極譜為S形,而示波極譜呈峰形狀,比經典極譜靈敏度高4~6倍。相鄰峰分辨好,分析速度也快。
3、極譜催化波
在極譜電流中有一種電流,其大小不是取決于去極劑的擴散速度,而是取決:
于伴隨電極過程的化學反應速度,這類極譜電流總稱為極譜動力波。化學反應與電極反應平行的極譜波稱為極譜催化波。在下列反應中:

電活性物質Ox在電極上還原,生成還原性的Red。這時溶液中事先加入過量的能與。Red反應又生成Ox的另一種物質Z,此再生的Ox在電極上又一次還原。這樣循環往復,使電流大大增加,從而提高了測定的靈敏度。反應中Ox相當于一種催化劑,催化了Z的還原。催化電流與催化劑Ox的濃度成正比,且比單純只是擴散電流時大許多倍,因此提高了測定的靈敏度。
4、循環伏安法
循環伏安法是用途最廣泛的研究電活性物質的電化學分析方法,在電化學、無機化學、有機化學、生物化學等領域中得到了廣泛的應用。電化學研究中常常首先進行的是循環伏安行為研究,因為它能在很寬的電位范圍內迅速觀察研究對象的氧化還原行為。
循環伏安法是在工作電極上施加一個線性變化的循環電壓來記錄電流隨電位的變化曲線,施加的電壓為等邊三角波或等邊階梯波,電位可向陽極方向掃描,也可向陰極方向掃描。典型的循環伏安圖如圖8.6所示,選擇施加在日點的起始電位Ei,然后沿負的電位即正向掃描,如箭頭所指的方向。當電位負到將去極劑Ox還原時,d點產生的陰極電流是由于如下的電極過程:
Ox+e→Red
陰極電流迅速增加(b一d)至電極表面Ox的濃度接近零,電流在d點達到最高峰,然后迅速衰減(d―g),因為電極附近溶液中的Ox電解轉變為Red而耗盡。對于反向掃描,在f處掃描轉向正的電位。該電位仍相當負,可以還原Ox,所以盡管沿正的方向掃描但仍有陰極電流。當電位繼續沿正的方向掃描時,在電極附近聚集的Red通過下面電極過程被氧化:
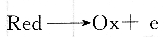
產生陽極電流(i-k)。陽極電流迅速增加至Red的表面濃度接近零,電流達到峰值j。然后由于電極附近溶液中Red耗盡,電流將衰減(j一k)。當電位達到a點的起始電位Ei時完成了第一個循環。
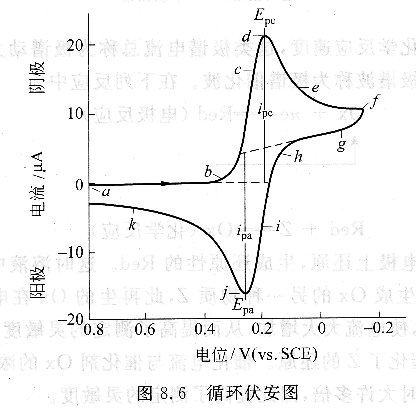
循環伏安圖的幾個重要參數為:陽極峰電流值(ipa)、陰極峰電流值(ipc)、陽極峰電位值(Epa)、陰極峰電位值(Epc)。循環伏安法特別適用于研究電化學反應的可逆、反應動力學和反應中間體。若已知擴散系數,利用循環伏安法可求得電極反應的電子轉移個數或已知電子轉移個數、可測擴散系數。對于可逆反應,陰陽極峰電位差為57/n mV,峰電位與掃描速度無關,而峰電流與掃描速度的平方根成正比。若峰電位大于57/n mV,則該電極反應為準可逆反應;若反掃時電流消失,則該反應為不可逆反應。
5、溶出伏安法
溶出伏安法是將電化學富集與測定方法有機地結合在一起的一種電化學方法。先將被測物質通過陰極還原或陽極氧化富集在一個固定電極上,再由負向正電位方向或由正向負電位方向掃描溶出,根據溶出極化曲線來進行分析測定。陽極溶出伏安法的峰高與溶液中金屬離子濃度、電解富集時間、電解時攪拌速度、電極表面的大小及溶出時電位掃描速度等因素有關。在所有其他條件固定不變時,峰高與溶液中金屬離子濃度成正比,故可作定量分析。
溶出伏安法最大的優點是靈敏度非常高,陽極溶出法檢出限可達10-12mol/L。溶出伏安法測定精度良好,靈敏度高,能同時進行多組分測定且不需要貴重儀器,是一種較為實用的分析方法。
脈沖極譜法是目前伏安曲線極譜技術中靈敏度最高的一種方法,按脈沖電位的方式不同分為常規脈沖極譜法和微分脈沖極譜法兩種。微分脈沖極譜是在每一汞滴增長到一定時間(如1s或2s)時,在直流線性掃描電壓上疊加一個2~100mV的脈沖電壓,脈沖持續時間為4~80ms,測定脈沖加入前后電解電流之差,使干擾的電容電流和毛細管噪聲充分衰減。此法得到的極譜曲線呈現峰形,通過測量峰高度進行定量。若與陽極溶出法結合,稱為微分脈沖陽極溶出法,可達到更高的靈敏度,可測至10-11~10-12mol/L。
參考資料:現代儀器分析實驗與技術







