分析化學中的分離與富集方法
發布時間:2017-09-01
一、概述
在定量分析中,由于實際樣品的復雜性,當測定某一組分時,不可避免存在很多干擾物質,通過適當控制實驗條件或采用掩蔽法可以消除某些干擾,而分離是消除干擾最根本最徹底的方法。對于微量組分的測定,當方法靈敏度受到限制時,在分離的同時還應增大微量待測組分的濃度(富集)以提高測定的準確性。分離在定量分析中的作用體現在以下幾點:①將被測組分從復雜體系中分離出來后測定;②把對測定有干擾的組分分離除去;③將性質相近的組分相互分開;④把微量或痕量的待測組分通過分離達到富集的目的。
定量分析對分離的要求是待測組分A在分離過程中的損失要小,即回收完全;干擾組分B的殘留量小至不再干擾。一般用兩個量化參數評價分離效果,即回收率(回收因子)和分離率(分離因子)。對待測組分A來說:
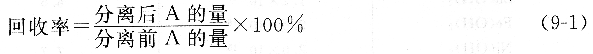
分離率用來表達A與B的分離程度:
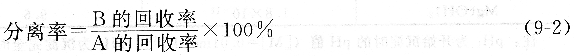
分離率越低或干擾組分B的回收率越低,A和B之間的分離越完全,干擾組分越容易消除。常量分析中,要求分離率小于10-3;痕量分析要求小于10-6。回收率越高越好,但是在分離過程中,被測組分難免有所損失。
在實際工作中,常用加入法來測回收率。對回收率的要求隨被測組分的含量的不同而不同。在一般情況下,對質量分數大于1%的組分,回收率應大于99.9%;對質量分數為0.01%~1%的組分,回收率應大于99%;質量分數低于0.01%的痕量組分,回收率為90%~95%,有時更低一些也允許。
在分析化學中,常用的分離和富集方法有沉淀分離法、液-液萃取分離法、離子交換分離法、液相色譜法等,它們的共同點是都使待分離組分分別處于不同的兩相中,然后用物理方法分離兩相,從而將待分離物分離。如沉淀分離法涉及液相和固相,液-液萃取分離法涉及水相和有機相,離子交換分離法涉及液相(洗脫劑)和固相(樹脂),液相色譜法涉及液相(流動相)和固相(固定相)兩相。近年來,還出現了一些新型的分離和富集技術如固相微萃取、液相微萃取、超臨界流體萃取和液膜萃取分離法等。
1、沉淀分離法
沉淀分離是一種經典的分離方法,它是根據溶度積原理,利用沉淀反應進行分離的方法。對沉淀反應的要求:所生成的沉淀溶解度小、純度高、穩定。對于常量組分的分離,較常用的是氫氧化物沉淀分離法、硫化物沉淀分離法、硫酸鹽沉淀分離法等。對痕量組分的分離富集,可采用無機沉淀劑,也可采用有機沉淀劑。
2、氫氧化物沉淀分離法
大多數金屬離子都能生成氫氧化物沉淀,由于各種氫氧化物沉淀的溶度積有很大差別,因此可以通過控制溶液酸度使某些金屬離子相互分離。同一濃度的不同金屬離子氫氧化物開始沉淀和沉淀完全的pH不同(表9―1)。
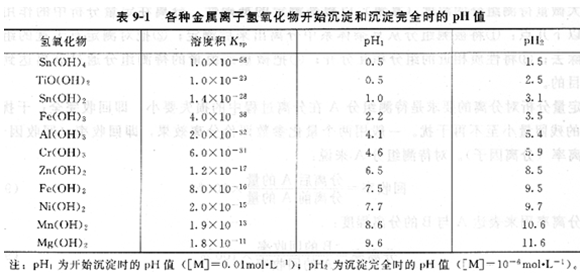
常用的沉淀劑介紹如下。
(1)氫氧化鈉
NaOH是強堿,采用其作沉淀劑可使兩性元素與非兩性元素分離,兩性元素以含氧酸陰離子形態留在溶液中,非兩性元素則生成氫氧化物沉淀。一般得到的氫氧化物沉淀為膠體沉淀,共沉淀嚴重,所以分離效果不理想。
NaOH作為沉淀劑可定量沉淀的離子有:Mg2+、Cu2+、Ag+、Au+、Cd2+、Hg2+、Ti(Ⅳ)、Zr(Ⅳ)、Hr(Ⅳ)、Tb(Ⅳ)、Bi3+、Fe3+、C02+、Ni2+、Mn2+。
部分沉淀的離子:Ca2+、Sr2+、Ba2+、Nb(V)、Ta(V)。
溶液中存在的離子:A10-2、CrO-2、ZnO2-2、PbO2-2、SnO2-3、GeO2-3、BeO2-2、SiO2-3、WO2-4、MoO2-4、VO-3。
(2)氨緩沖溶液
在銨鹽存在下,加入氨水調節和控制溶液的pH為8~9,可使高氧化值的金屬離子(如Fe3+、Al3+等)與大部分低氧化值(1、2)的金屬離子分離。氨緩沖溶液沉淀分離法中常加入NH4Cl等銨鹽,其作用是:①控制溶液的pH為8~9,防止Mg(OH)2沉淀和減少Al(OH)。的溶解;②用NH產作為抗衡離子,減少了氫氧化物對其他金屬離子的吸附;③大量存在的電解質促進了膠體沉淀的凝聚。
定量沉淀的離子:Hg2+、.Be2+、Fe3+、A13+、Cr3+、Bi3+、Sb(Ⅲ)、Sn(Ⅳ)、Mn2+、Ti(Ⅳ)、Zr(Ⅳ)、Hf(Ⅳ)、Tb(Ⅳ)、Nb(V)、Ta(V)、U(Ⅵ)。
部分沉淀的離子:Mn2+、Fe2+(有氧化劑存在時可以定量沉淀)、Pb2+(有Fe3+、Al3+共存時將被共沉淀)。
溶液中存留的離子:Ag(NH3)2+、Cu(NH3)2+4、Cd(NH3)2+4、Co(NH3)3+6、Ni(NH3)2+4、Zn(NH3)2+4、Ca2+、Sr2+、Ba2+、Mg2+。
3、硫化物沉淀分離法
硫化物沉淀分離是根據各種硫化物的溶度積相差比較大的特點,通過控制溶液的酸度來控制硫離子濃度,而使金屬離子相互分離。約40余種金屬離子可生成難溶硫化物沉淀,硫化氫是常用的沉淀劑,根據H2S的弱酸性,溶液中S2-的濃度與pH有關,控制溶液pH可控制分步沉淀。在進行分離時大多用緩沖溶液控制酸度,硫化物沉淀分離的選擇性不高,沉淀大多是膠體,共沉淀現象比較嚴重,而且還存在后沉淀現象,故分離效果不理想。但利用其分離某些重金屬離子還是有效的。
4、有機沉淀劑沉淀分離法
與無機沉淀劑相比,有機沉淀劑的選擇性和靈敏度都較高,生成的沉淀純凈,溶解度小,易于過濾洗滌,故有機沉淀劑在沉淀分離法中的應用日益廣泛,有機沉淀劑的研究和應用是沉淀分離法的發展方向。有機沉淀劑按其作用原理分為:螯合物沉淀劑、離子締合物沉淀劑和三元配合物沉淀劑。其中,三元配合物沉淀反應相對而言,選擇性和靈敏度更高,而且生成的沉淀組成穩定、相對分子質量大,作為重量分析的稱量形式也更合適,近年來應用較廣。
5、共沉淀分離和富集痕量組分
在重量分析中,共沉淀現象是一種消極因素,而在分離方法中,卻能利用共沉淀現象來分離和富集微量組分。共沉淀分離法是在試液中加入一種試劑,使其產生一種共沉淀劑(作為載體),使被測定的組分因共沉淀作用而與共沉淀劑一同析出,以達到分離與富集的目的。
二、無機共沉淀劑
無機共沉淀劑的作用主要是通過對痕量組分的表面吸附、吸留或與痕量組分形成混晶,而把痕量組分載帶下來。
(1)利用表面吸附進行共沉淀
在這種方法中,常用的共沉淀劑為氫氧化物和硫化物等膠體沉淀。由于膠體沉淀的比表面大,吸附能力強,故有利于痕量組分的共沉淀。但這種共沉淀方法的選擇性不高,需選擇適宜的共沉淀劑和沉淀條件才能得到較好的分離效果。
(2)利用生成混晶體進行共沉淀
該方法選擇性比吸附共沉淀法高,分離效果好。常見的混晶體有:BaSO4-RaSO4,BaS04-PbSO4,MgNH4 P04 -MgN H4 As04等。
三、有機共沉淀劑
有機共沉淀劑應用較多,相對于無機共沉淀劑,它具有以下特點:有機共沉淀劑可經灼燒而除去,被測組分則被留在殘渣中,用適當的溶劑溶解后即可測定;有機共沉淀劑的相對分子質量較大,體積也大,有利于微量組分的共沉淀;與金屬離子生成的難溶性化合物表面吸附少,沉淀完全,沉淀較純凈,選擇性高,分離效果好。有機共沉淀一般以下列三種方式進行共沉淀分離。
(1)利用膠體的凝聚作用進行共沉淀
鎢、鈮、鉭和硅等的含氧酸常沉淀不完全,有少量的含氧酸以帶負電荷的膠體微粒留于溶液中,形成膠體溶液,可用辛可寧、單寧、動物膠等將它們共沉淀下來。例如,在鎢酸的膠體溶液中,可加人生物堿辛可寧,辛可寧在酸性的溶液中,其氨基被質子化而形成帶正電的膠粒,能與帶負電荷的鎢酸膠體凝聚而共沉淀下來。
(2)利用形成離子締合物進行共沉淀
一些分子質量較大的有機化合物,如甲基紫、孔雀綠、品紅及亞甲基藍等,在酸性溶液中帶正電荷,當它們遇到以配陰離子形式存在的金屬配離子時,能生成微溶性的離子締合物而被共沉淀出來。
在這種共沉淀體系中,作為金屬配陰子的配位體的有Cl一、Br-、I一、SCN一等;被共沉淀的金屬離子有Zn2+、In(Ⅲ)、Cd2+、Hg2+、Bi3+、Au(Ⅲ)、Sb(Ⅲ)等。
(3)利用惰性共沉淀劑
Ni2+與丁二酮肟生成螯合物沉淀,但當Ni2+含量很低時,丁二酮肟不能將其沉淀出來,若再加入丁二酮肟二烷酯的乙醇溶液,因丁二酮肟二烷酯難溶于水,則在水溶液中析出并將Ni2+與丁二酮肟的螯合物共沉淀下來。丁二酮肟二烷酯與Ni2+及其螯合物都不發生反應,故稱這類載體為“惰性共沉淀劑”,常用的還有酚酞、a-萘酚等。對于惰性共沉淀劑的作用,可理解為利用“固體萃取劑”進行沉淀,即先將無機離子轉化為疏水性化合物,再根據相似相溶的原則使其進入結構相似的載體,將疏水化合物載帶下來,進而達到分離的目的。
參考資料:分析化學







