首頁>技術(shù)中心>技術(shù)資訊>滴定分析法概論
滴定分析法概論
發(fā)布時間:2017-09-01
滴定分析法是定量化學(xué)分析中最重要的分析方法之一,在分析檢測中應(yīng)用很廣,主要用在常量分析中,適用于常量組分的測定,其準(zhǔn)確度較高,通常相對誤差RE≤±0.2%。
滴定分析法是將已知準(zhǔn)確濃度的試劑溶液通過滴定管滴加到待測組分溶液中,直到兩者恰好完全定量反應(yīng)為止,然后根據(jù)所加試劑的濃度和消耗的體積,計算待測組分的含量。
一、滴定分析法的術(shù)語
標(biāo)準(zhǔn)溶液:已知準(zhǔn)確濃度的溶液,又叫滴定劑或定規(guī)液。
滴定:將標(biāo)準(zhǔn)溶液通過滴定管滴加到被測物質(zhì)溶液中的操作過程稱為滴定。
化學(xué)計量點:當(dāng)標(biāo)準(zhǔn)溶液與被測物質(zhì)恰好完全定量反應(yīng)時稱為化學(xué)計量點,此時正好符合化學(xué)反應(yīng)式的計量關(guān)系,化學(xué)計量點又叫理論終點。
滴定終點:在滴定過程中,因指示劑顏色發(fā)生明顯變化或用儀器指示而停止滴定時稱為滴定終點。
終點誤差:在實際分析中滴定終點與理論終點(即化學(xué)計量點)往往不可能完全一致,由此而引起的誤差稱為終點誤差,終點誤差用Et表示,是滴定分析方法誤差的主要來源,又稱滴定誤差,它的大小取決于所用方法的化學(xué)反應(yīng)平衡常數(shù)K和所選用的指示劑。
輔助試劑:為保持化學(xué)反應(yīng)在一定條件下進(jìn)行而加入的酸、堿、緩沖溶液、掩蔽劑等。
滴定分析法要具備的條件有:滴定分析反應(yīng)、標(biāo)準(zhǔn)溶液、容量儀器、指示劑等,滴定分析誤差也正是來自于這幾個方面,即由于滴定反應(yīng)的不完全,標(biāo)準(zhǔn)溶液濃度的不準(zhǔn)確,容量儀器的精度限制或未經(jīng)校正,指示劑誤差以及操作者誤差等為滴定分析帶來誤差。
二、滴定反應(yīng)的條件
適用于滴定分析法的化學(xué)反應(yīng)應(yīng)具備下列條件:
(1)反應(yīng)必須按一定的化學(xué)反應(yīng)方程式定量完成,無副反應(yīng)發(fā)生,即有定量的計算關(guān)系。
(2)反應(yīng)速率要快,可以正確地控制滴定終點。對于速率慢的反應(yīng),應(yīng)采取適當(dāng)?shù)拇胧┨岣叻磻?yīng)速率或者改變滴定方式。
(3)有適當(dāng)?shù)姆椒ù_定滴定終點,如指示劑法和儀器法等。
凡能滿足上述要求的反應(yīng)均可用于滴定分析,如果有的樣品的分析不符合上述條件,可以通過采取各種強(qiáng)化措施使其最終成為能用于滴定分析的反應(yīng),也可通過改變滴定程序的方法來進(jìn)行測定。
三、商定分析法的分類
(一)按反應(yīng)類型分類
1、酸堿滴定法
以酸堿反應(yīng)(中和反應(yīng))為基礎(chǔ)的滴定分析法叫酸堿滴定法。
酸堿滴定法即以標(biāo)準(zhǔn)酸溶液測定堿和以標(biāo)準(zhǔn)堿溶液測定酸的滴定分析法。
2、氧化還原滴定法
以氧化還原反應(yīng)為基礎(chǔ)的滴定分析法叫氧化還原滴定法。如高錳酸鉀法、重鉻酸鉀法、碘量法、溴酸鹽法、鈰量法等。
3、配位滴定法
以配位反應(yīng)為基礎(chǔ)的滴定分析法叫配位滴定法,主要有EDTA滴定法等。
4、沉淀滴定法
以沉淀反應(yīng)為基礎(chǔ)的滴定分析法叫沉淀滴定法,如以生成難溶性銀鹽為基礎(chǔ)的銀量法等。
(二)按滴定方式不同分類
1、直接滴定法
用標(biāo)準(zhǔn)溶液直接滴定被測物質(zhì)溶液進(jìn)行測定的方法稱為直接滴定法。這類滴定法必須要滿足滴定條件。如果反應(yīng)不能滿足滴定反應(yīng)條件,可以采用下述幾種滴定方式進(jìn)行滴定。
2、返滴定法
通常是在待測試液中準(zhǔn)確加入適當(dāng)過量的標(biāo)準(zhǔn)溶液,待反應(yīng)完全后,再用另一種標(biāo)準(zhǔn)溶液返滴定剩余的第一種標(biāo)準(zhǔn)溶液,從而測定被測組分含量,這種方法稱為返滴定法,也叫剩余量滴定法或回滴法。該方法適用于反應(yīng)較慢、需加熱、被測物為不易溶解的固體物質(zhì)或直接滴定無合適的指示劑等反應(yīng)。
例如,碳酸鈣含量的測定采用的就是返滴定法。

3、置換滴定法
先加人適當(dāng)?shù)脑噭┡c待測組分定量反應(yīng),生成另一種可被滴定的物質(zhì),再用標(biāo)準(zhǔn)溶液滴定反應(yīng)產(chǎn)物,這種滴定方法稱為置換滴定法。
這種方法適用于不能與標(biāo)準(zhǔn)溶液直接反應(yīng)的物質(zhì)或者反應(yīng)中有副反應(yīng)的情況等。
例如,用重鉻酸鉀(K2Cr2O7)標(biāo)定Na2S2O3溶液的濃度,即在酸性重鉻酸鉀溶液中加入過量碘化鉀(KI),定量析出I2,再用Na2S2O3標(biāo)準(zhǔn)溶液滴定I2,反應(yīng)關(guān)系為:
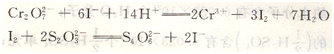
4、間接滴定法
有的被測物不能直接與標(biāo)準(zhǔn)溶液反應(yīng),但能與另一種可與標(biāo)準(zhǔn)溶液直接作用的物質(zhì)反應(yīng),就可以通過反應(yīng)使被測物質(zhì)轉(zhuǎn)換為能與標(biāo)準(zhǔn)溶液反應(yīng)的物質(zhì)進(jìn)行滴定。這種滴定方式稱為間接測定法。
例如,鈣離子的測定就是采用高錳酸鉀法間接測定的:
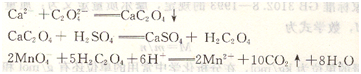
通過滴定方式的變換,更加擴(kuò)展了滴定分析的應(yīng)用范圍。
參考資料:分析化學(xué)







