配位滴定方式及其應用
發布時間:2017-09-01
在配位滴定中,采用不同的滴定方式,不僅可以擴大配位滴定的應用范圍,而且可以提高配位滴定的選擇性。
1、直接滴定法
這種方法是用EDTA標準溶液直接滴定待測金屬離子。采用直接滴定法必須滿足下列條件:
①被測離子濃度CM及其與EDTA形成的配合物的條件穩定常數K,MY的乘積應滿足準確滴定的要求,即lgcK’MY≥6。
②被測離子與EDTA的配位反應速率快。
③應有變色敏銳的指示劑,且不發生封閉現象。
④被測離子在滴定條件下,不會發生水解和沉淀反應。
直接滴定法操作簡單,一般情況下引入的誤差較少,因此只要條件允許,應盡可能采用直接滴定法。表列出了EDTA直接滴定一些金屬離子的條件。
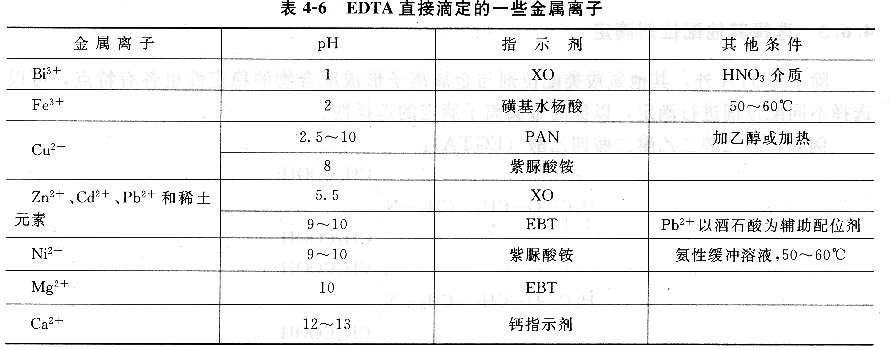
例如,水硬度的測定就是直接滴定法的應用。水的總硬度是指水中鈣、鎂離子的含量,由鎂離子形成的硬度稱為鎂硬,由鈣離子形成的硬度稱為鈣硬。測定方法如下:先在pH≈10的氨緩沖溶液中,以EBT為指示劑,用EDTA滴定,測得的是Ca2+、Mg2+總量。另取同量試液,加入NaOH調節pH>12,此時Mg2+以Mg(OH)2沉淀形式被掩蔽,用鈣指示劑,EDTA滴定Ca2+,終點由紅色變為藍色,測得的是Ca2+的含量。前后兩次測定之差,即可得到Mg2+含量。
2、返滴定法
返滴定法是在試液中先加入已知過量的EDTA標準溶液,然后用其他金屬離子標準溶液滴定過量的EDTA,根據兩種標準溶液的濃度和所消耗的體積,即可求得被測物質的含量。
例如,EDTA滴定A13+時,因為Al3+與EDTA 的反應速率慢;酸度不高時,A13+水解生成多核羥基配合物;A13+對二甲酚橙等指示劑有封閉作用,因此不能直接滴定A13+。采用返滴定法即可解決這些問題,方法是先加入已知過量的EDTA標準溶液,在pH≈3.5(防止A13+水解)時,煮沸溶液來加速A13+與EDTA的配位反應。然后冷卻,并調節pH至5~6,以保證A13+與EDTA配位反應定量進行。以XO為指示劑,此時A13+已形成A1Y配合物,不再封閉指示劑。過量的EDTA可用Zn2+或Pb2+標準溶液返滴定,即可測得A13+的含量。
特別注意的是,作為返滴定的金屬離子,與EDTA配合物的穩定性要適當。即要有足夠的穩定性以保證滴定的準確度,但不宜超過被測離子與EDTA配合物的穩定性,否則在滴定過程中,返滴定劑會將被測離子置換出來,造成測定誤差,而且終點也不敏銳。
返滴定法主要用于以下情況:
①被測離子與EDTA反應速率慢。
②被測離子對指示劑有封閉作用,或者缺乏合適的指示劑。
③被測離子發生水解等副反應。
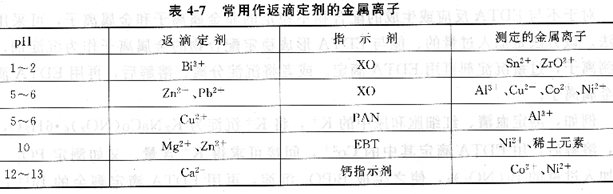
表列出了一些常用作返滴定劑的金屬離子。
3、置換滴定法
利用置換反應,置換出相應數量的金屬離子或EDTA,然后用EDTA或金屬離子標準溶液滴定被置換出來的金屬離子或EDTA,這種方法稱為置換滴定法。
(1)置換出金屬離子
當被測離子M與EDTA反應不完全或形成的配合物不穩定時,可用M置換出另一配合物(NL)中的N,然后用EDTA滴定N,即可求得M的含量。
M+NI=ML+N
例如,Ag+與EDTA的配合物不穩定,不能用直接法滴定,但是將Ag+加入到Ni(CN)2-4溶液中,則Ni2+被置換出來:
2Ag十+Ni(CN)2一4=2Ag(CN)2-+Ni2+
在Ph=10的氨性緩沖溶液中,以紫脲酸銨作指示劑,用EDTA滴定置換出來的Ni2+,即可求得Ag+的含量。
(2)置換出:EDTA
先將被測離子M與干擾離子全部用EDTA配位,加入選擇性高的配位劑L,生成ML,從而釋放出與M等物質的量的EDTA:
MY+L=ML+Y
反應完全后,再用另一金屬離子標準溶液滴定釋放出來的EDTA,即可測得M的含量。
4、間接滴定法
對于不與EDTA反應或生成的配合物不穩定的非金屬離子和金屬離子,可采用間接滴定法。該方法是加入過量的、能與EDTA形成穩定配合物的金屬離子作為沉淀劑,以沉淀待測離子,過量沉淀劑再用EDTA滴定。或者將沉淀分離、溶解后,再用EDTA滴定其中的金屬離子。
參考資料:分析化學







