首頁>技術中心>技術資訊>定量分析中的分離方法及一般分析步驟(二)
定量分析中的分離方法及一般分析步驟(二)
發(fā)布時間:2017-09-01
2、常用螯合劑
金屬離子與螯合劑(亦稱萃取配合劑)的陰離子結合形成中性螯合物分子。這類金屬螯合物難溶于水而易溶于有機溶劑,因而能被有機溶劑所萃取,如丁二酮肟。常用的螯合劑還有8-羥基喹啉、雙硫腙、乙酰丙酮和噻吩甲酰三氟丙酮(TTA)等。
三、離子交換分離法
利用離子交換劑與溶液中的離子發(fā)生交換作用使離子分離的方法,稱為離子交換分離法。
(一)離子交換樹脂
離子交換樹脂是具有網(wǎng)狀結構的復雜有機高分子聚合物。網(wǎng)狀結構的骨架部分一般很穩(wěn)定,不溶于酸、堿和一般溶劑。在網(wǎng)狀結構的骨架上有許多可被交換的活性基團。根據(jù)活性基團的不同,離子交換樹脂可分為陽離子交換樹脂和陰離子交換樹脂兩大類。
1、陽離子交換樹脂
陽離子交換樹脂含有酸性基團,如應用最廣泛的強酸性磺酸型聚苯乙烯樹脂,它是以苯乙烯和二乙烯苯聚合,經(jīng)濃硫酸磺化而制得的聚合物。這種樹脂的化學性質很穩(wěn)定,具有耐強酸、強堿、氧化劑和還原劑的性質,因此應用非常廣泛。
各種陽離子交換樹脂含有不同的活性基團,常見的有磺酸基(一SO2H)、羧基(-COOH)和酚基(-OH)等。根據(jù)活性基團離解出H+能力的大小不同,將陽離子交換樹脂分為強酸性和弱酸性兩種。例如,含一SO3H的為強酸性陽離子交換樹脂,常用R―SO3H表示(R表示樹脂的骨架脂,分別用R-COOH和R―OH表示。交換反應為:
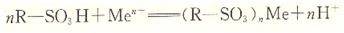
式中,Men+代表陽離子。
這種交換反應是可逆的,已交換的樹脂用酸處理時,反應便向相反方向進行,樹脂又恢復原狀,這一過程為“再生過程”,亦稱洗脫過程。
強酸性陽離子交換樹脂應用較廣泛,弱酸性陽離子交換樹脂的H+不易鋸離,所以在酸性溶液中不能應用,但它的選擇性較高而且易洗脫。
2、陰離子交換樹脂
陰離子交換樹脂與陽離子交換樹脂具有同樣的有機骨架,只是所聯(lián)的活性基團為堿性基團。如含季胺基(-N+(CH3)3)的樹脂稱為強堿性陰離子交換樹脂,含伯胺基(-NH2)、仲胺基(-NHCH3)和叔胺基(一N(CH3)2)的樹脂為弱堿性陰離子交換樹脂。這些樹脂水化后分別形成 R-NH3OH, R―NH 2 CH。OH,R―NH(CH3)2OH 和R-N(CH3)3OH等氫氧型陰離子交換樹脂,所聯(lián)的OH-能被陰離子交換。交換和洗脫過程可表示為:

陰離子交換樹脂的化學穩(wěn)定性及耐熱性能都不如陽離子交換樹脂。
(二)離子交換分離的操作方法
在分析工作中,為了分離或富集某種離子,一般采用動態(tài)交換,這種交換方法在交換柱中進行。其操作過程如下:
1、樹脂的選擇和處理
在化學分析中應用最多的為強酸性陽離子交換樹脂和強堿性陰離子交換樹脂。生產(chǎn)上出廠的交換樹脂顆粒大小往往不夠均勻,故使用時應當先過篩以除去太大及太小的顆粒,也可以用水泡脹后用篩在水中選取大小一定的顆粒備用。
一般商品樹脂都含有一定量的雜質,所以在使用前必須進行凈化處理。對強堿性和強酸性陰陽離子交換樹脂,通常用4 mol/L的鹽酸溶液浸泡1~2 d,以溶解各種雜質,然后用蒸餾水洗滌至中性。這樣就得到在活性基團上含有可被交換的H+或C1-的氫型陽離子交換樹脂或氯型陰離子交換樹脂。如果需要鈉型陽離子交換樹脂,則用硫酸處理氯型陰離子交換樹脂,這一過程稱為轉型。轉型之后亦需再用蒸餾水洗凈。
2、離子交換柱的準備
離子交換通常在離子交換柱中進行。離子交換柱一般用玻璃制成,裝置交換柱時,先在交換柱的下端鋪上一層玻璃絲,灌入少量水,然后傾人帶水的樹脂,樹脂就下沉形成交換層,再蓋上一層玻璃絲。由于交換層的上端比溶液的流出口低,這樣就可使交換層浸在液面下而不致使溶液流空。交換柱裝好以后,再用蒸餾水洗滌,關上活塞,備用。應當注意,不能使樹脂露出水面,因為樹脂露于空氣中,當加入溶液時,樹脂間隙中會產(chǎn)生氣泡,而使交換不完全。
交換柱也可以用滴定管代替。
3、交換過程
將試液加到交換柱上,用活塞控制一定的流速進行交換。經(jīng)過一段時間之后,上層樹脂全部被交換,下層未被交換,中間則部分被交換,這中間的一段稱為“交界層”。如果以“+”表示已交換的樹脂,以“。”表示未被交換的樹脂,隨著交換的進行,交界層逐漸下移,至流出液中開始出現(xiàn)被交換離子時,稱為始漏點(亦稱泄漏點或突破點),此時交換柱上被交換離子的毫克當量①數(shù)稱為始漏量。在到達始漏點時,交界層的下端剛到達交換柱的底部,而交換層中尚有未交換的樹脂存在,因此始漏量總是小于總交換量。
4、洗脫過程
當交換完畢之后,一般用蒸餾水洗去殘存溶液,然后用適當?shù)南疵撘哼M行洗脫。在洗脫過程中,上層被交換的離子先被洗脫下來,經(jīng)過下層未被交換的樹脂時,又可發(fā)再度被交換。因此,最初洗脫液中被交換離子的濃度等于零。隨著洗脫的進行,洗出液中離子濃度逐漸增大,達到最大值之后又逐漸減小,至完全洗脫之后,被洗出之離子濃度又等于零。取V1~V2一段體積的溶液,即可測定被交換離子的含量。對于陽離子交換樹脂常采用鹽酸溶液作為洗脫液,經(jīng)過洗脫之后樹脂轉為氫型;陰離子交換樹脂常用氯化鈉或氫氧化鈉溶液作為洗脫液,經(jīng)過洗脫液洗脫之后,樹脂轉為氯型或氫氧型。因此,洗脫之后的樹脂已得到再生,用蒸餾水洗滌干凈即可再次使用。
四、液相色譜分離法
液相色譜分離法又稱層析分離法,這種方法是由一種流動相帶著試樣經(jīng)過固定相,物質在兩相之間進行反復的分配,由于物質在兩相之間的分配系數(shù)不同,移動速度也不一樣,從而達到互相分離的目的。液相色譜分離法有多種類型,按其操作的形式不同,可分為柱中色譜法、紙上色譜法和薄層色譜法等。
(一)柱中色譜法
柱中色譜法是把吸附劑(如氧化鋁、硅膠等)裝在一支玻璃管中,做成色譜柱。然后將試液加在柱上,如試液中含有A與B兩種組分,則A和B便被吸附劑(固定相)吸附在柱的上端,再用一種洗脫劑(亦稱展開劑)進行沖洗。由于各種物質在吸附劑表面上具有不同的吸附選擇性和吸附牢度,所以在用展開劑沖洗過程中,管內(nèi)就連續(xù)不斷地發(fā)生溶解、吸附、再溶解、再吸附的現(xiàn)象。由于展開劑與吸附劑二者對A和B的溶解能力和吸附能力不同,即A與B的分配系數(shù)不同,則A和B的移動距離也不相同。當沖洗到一定程度時,兩者即可以完全分開,形成兩個帶。再繼續(xù)沖洗,A物質便從柱中流出來,承接于一個容器中,B物質后被洗脫下來,可用另一容器承接,這樣便可將A與B兩種物質分離。
色譜分離法的機理可由溶質在流動相和固定相之間的分配過程來討論。分配進行的程度可用分配系數(shù)D表示,即:
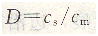
式中:cS――溶質在固定相中的濃度;
cm――溶質在流動相中的濃度;
D――分配系數(shù),在低濃度和一定溫度時是一個常數(shù)。
當吸附劑一定時,D的大小決定于溶質的性質。D大的物質被吸附得牢固,移動速度慢,在沖洗時最后洗脫下來;D=0的物質不被吸附,將隨同流動相迅速流出。各組分之間的D差別越大,越容易彼此分離。各種物質對于不同的吸附劑和展開劑和展開劑有不同的D,因此,為了達到完全分離的目的,必須根據(jù)被分離物質的結構和性質(極性)選擇及樣度,適宜的吸附劑和展開劑。
對吸附劑的基本要求:(1)具有較大的吸附表面和一定的吸附能力;(2)與展開劑及樣品中各組分不起化學反應,在展開劑中不溶解;(3)吸附劑的顆粒要有一定的細度,并且粒度要均勻。常用的吸附劑有氧化鋁、硅膠、聚酰胺等。
展開劑的選擇與吸附劑吸附能力的強弱和被分離物質的極性大小有關。應用吸附性弱的吸附劑分離性較大的物質時,則選用極性較大的展開劑容易洗脫;應用吸附性強的吸附劑,分離極性較小的物質時,則選用極性較小的展開劑容易洗脫。
常用的展開劑極性大小次序為:
水>乙醇>丙酮>正丁醇>乙酸乙酯>氯仿>乙醚>甲苯>苯>四氯化碳>環(huán)己烷>石油醚
以上只是一般的規(guī)則,在工作中還必須通過實驗來選擇合適的吸附劑和展開劑,并確定其他分離條件。
參考資料:分析化學







