首頁>技術(shù)中心>技術(shù)資訊>定量分析中的分離方法及一般分析步驟(四)
定量分析中的分離方法及一般分析步驟(四)
發(fā)布時間:2017-09-01
2、制樣
采取的原始試樣通常不僅量太大,且顆粒大而不均勻,不適宜用作分析,因此應(yīng)先將其制備成量少而高度均勻的分析試樣。制備試樣的方法分為粉碎、過篩、混勻和縮分四個步驟。
(1)粉碎
大塊試樣應(yīng)用壓碎機(如顎氏碎樣機、球磨機等)粉碎成小的顆粒。在粉碎過程中,要盡量避免由于設(shè)備的磨損等原因而混進雜質(zhì),并應(yīng)防止粉末的飛散。
(2)過篩
根據(jù)不同試樣顆粒粒度的要求,選用標準篩進行過篩。凡不能過篩的必須重新回到第一步再粉碎。因為這部分顆粒往往具有不同的組成,所以必須反復(fù)的研磨,使所有細粒都能通過篩孔,以保證所得均勻樣品能代表整個被測物料的平均組成。
(3)混勻
將過篩后的試樣用一定的方法進行混合。
(4)縮分
常用的方法有四分法和棋盤法,通常用四分法。將混合均勻的試樣堆成錐形,然后略微壓平,通過中心分為四等份,把任何相對的兩份棄去,其余相對的兩份收集在一起再混勻,這樣試樣便縮減了一半,稱為縮分一次。
八、試樣的分解
除干法(如光譜法)分析外,通常先要將試樣分解后制成分析試液。在分解試樣時要注意的原則:試樣分解必須完全,處理后的溶液中不得殘留原試樣的細屑或粉末;試樣分解過程中待測組分不應(yīng)揮發(fā)損失;不應(yīng)引入被測組分和干擾物質(zhì)。
由于試樣的性質(zhì)不同,分解的方法也有所不同。常用的分解方法有溶解和熔融兩種。
(一)溶解分解法
采用適當?shù)娜軇⒃嚇尤芙庵瞥扇芤海@種方法比較簡單、快速。常用的溶劑有水、酸和堿等。能溶于水的試樣一般稱為可溶性鹽類,如硝酸鹽、醋酸鹽、銨鹽、絕大部分的堿金屬化合物和大部分的氯化物、硫酸鹽等。對于不溶于水的試樣,則采用酸或堿作溶劑的酸溶法或堿溶法進行溶解,以制備分析試液。
1、酸溶法
酸溶法是利用酸的酸性、氧化還原性和形成絡(luò)合物的作用,使試樣溶解。鋼鐵、合金、部分氧化物、硫化物、碳酸鹽礦物和磷酸鹽礦物等,常采用此法溶解。常用的酸溶劑包括:
(1) 鹽酸(HCl)
鹽酸是分解試樣的重要強酸之一,它可以溶解金屬活動順序中氫以前的金屬及多數(shù)金屬氧化物和碳酸鹽。鹽酸中的Cl-可以和許多金屬離子生成穩(wěn)定的絡(luò)離子(如FeCl4-,SbCl4一等),對于這些金屬的礦石是很好的溶劑。
(2)硝酸(HNO3)
硝酸具有強的氧化性,所以硝酸溶液兼有酸和氧化作用,溶解能力強而且快。除鉑、金和某些稀有金屬外,濃硝酸能溶解幾乎所有的金屬試樣及其合金,大多數(shù)的氧化物、氫氧化物和幾乎所有的硫化物都能溶解。但金屬鐵、鋁、鉻等被氧化后,在金屬表面形成一層致密的氧化薄膜,使金屬與酸隔離,不能繼續(xù)起作用,這種現(xiàn)象稱為金屬的鈍化。為了溶去氧化物薄膜,必須加非氧化性的酸如鹽酸,才能達到溶樣的目的。
(3)硫酸(H2SO4)
熱濃硫酸具有強氧化性,除鋇,鍶,鈣,鉛外,其他金屬的硫酸鹽一般都溶于水。
因此,用硫酸可溶解鐵、鈷、鎳、鋅等金屬及其合全和鋁、鈹、錳、釷、鈦、鈾等礦石。硫酸沸點高(338℃),可在高溫下分解礦石,或用以逐去揮發(fā)性的酸(如鹽酸,硝酸,氫氟酸)和水分。在加熱蒸發(fā)過程中要注意在冒出SO3白煙時即應(yīng)停止加熱,以免生成難溶于水的硫酸鹽。
(4)磷酸(H3PO4)
磷酸是中強酸,PO43-具有很強的絡(luò)合能力,能溶解很多其他酸不溶的礦石,如鉻鐵、鈦鐵礦、鈮鐵礦和金紅石(TiO2)等。在鋼鐵分析中含高碳、高鉻、高鎢的合金鋼等,用磷酸溶樣效果很好。但須注意加熱溶解過程中溫度不能過高,時間不能過長,以免析出難溶性焦磷酸鹽。一般應(yīng)控制在500~600℃,時間在5 min以內(nèi)。
(5)高氯酸(HClO4)
在加熱情況下(特別是接近沸點203℃時)是一種強氧化劑和脫水劑。鉻、鎢可被氧化成鉻酸和鎢酸,所以常用來溶解鉻礦石、不銹鋼、鎢鐵礦石等。在加熱濃的高氯酸時,如遇有機物則由于劇烈的氧化作用而易發(fā)生爆炸,應(yīng)特別注意。
(6)氫氟酸(HF)
它是較弱的酸,具有強的絡(luò)合能力。氫氟酸主要用來分解硅酸鹽,生成揮發(fā)性的SiF4。在分解硅酸鹽和含硅化合物時,常與硫酸混合使用。
(7)混合酸
混合酸具有比單一酸更強的溶解能力,如單一酸不能溶解的HgS,可以溶解于混合酸王水中。
常用的混合酸有硫酸+磷酸、硫酸+氫氟酸、硫酸+高氯酸、鹽酸+硝酸+高氯酸等。
2、堿溶法
堿溶法的溶劑主要為氫氧化鈉和氫氧化鉀。堿溶法常用來溶解兩性金屬鋁、鋅及其合金,以及它們的氧化物、氫氧化物等。
在測定鋁合金中的硅時,用堿溶解使Si以SiO32-的形式轉(zhuǎn)到溶液中。如果用酸溶解則Si可能以SiH4的形式揮發(fā)損失,影響測定結(jié)果。
(二)熔融分解法
熔融分解法是將試樣與固體熔劑混合,在高溫下加熱使試樣的全部組分轉(zhuǎn)化成易溶于水或酸的化合物(如鈉鹽、鉀鹽、硫酸鹽或氯化物等)。根據(jù)所用熔劑的化學(xué)性質(zhì),可分為酸熔法和堿熔法兩種。
1、酸熔法
堿性試樣宜采用酸性熔劑。常用的酸性熔劑有焦硫酸鉀和硫酸氫鉀,后者經(jīng)灼燒后亦生成焦硫酸鉀。

所以兩者的作用是一樣的。這類熔劑在300℃以上可與堿或中性氧化物作用,生成可溶性的硫酸鹽。這種方法常用于分解氧化鋁、氧化鉻、四氧化三鐵、氧化鋯、鈦鐵礦、鉻礦、中性耐火材料(如鋁砂、高鋁磚)及堿性耐火材料(如鎂砂、鎂磚)等。
用焦硫酸鉀熔劑進行熔融時,溫度不能過高,防止SO3過多過早地損失掉。熔融物冷卻后用水溶解時應(yīng)加入少量酸,以免有些元素(如鈦、鋯)發(fā)生水解而產(chǎn)生沉淀。
2、堿熔法
酸性試樣宜采用堿熔法。如酸性礦渣、酸性爐渣和酸不溶性試樣均可采用堿熔法,使它們轉(zhuǎn)化為易溶于酸的氧化物或碳酸鹽。
常用的堿性熔劑有無水碳酸鈉(熔點850℃)、碳酸鉀(熔點891℃)、氫氧化鈉(熔點318℃)、過氧化鈉(熔點460℃)和它們的混合熔劑等。這些熔劑除有堿性外,在高溫下均可起氧化作用(自身氧化或空氣氧化),可以把一些元素氧化成高價,如Cr3+和Mn2+可以氧化成Cr(Ⅵ)與Mn(Ⅶ),從而增強了試樣的分解作用。有時為了增強氧化作用還加入硝酸鉀或次氯酸鉀,使氧化作用更為完全。
(1)無水碳酸鈉或碳酸鉀
常用來分解硅酸鹽和硫酸鹽等。分解反應(yīng)如下:
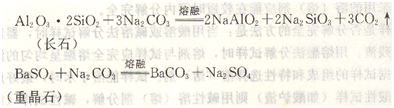
在熔融時常將碳酸鈉與碳酸鉀混合使用,可降低熔點到700℃左右。有時為了增強氧化性,采用碳酸鈉和硝酸鉀混合熔劑,可以使Crz0。轉(zhuǎn)化為Na2CrOt,二氧化錳轉(zhuǎn)化為過錳酸鈉(Na2MnO4)。常用的混合熔劑還有碳酸鈉+硫,用以分解砷、銻、錫的礦石,將它們轉(zhuǎn)化為硫代硫酸鹽。如錫石(SnO2)的分解反應(yīng)為:
![]()
(2)過氧化鈉
常用來分解含砷、銻、鉻、鉬、釩和錫的礦石及其合金。由于過氧化鈉是強氧化劑,能把其中大部分元素氧化成高價狀態(tài)。例如鉻鐵礦的分解反應(yīng)為:
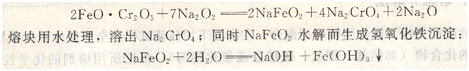
然后利用Na2CrO4溶液和氫氧化鐵沉淀分別測定鉻和鐵的含量。
有時為了減緩氧化作用的劇烈程度,過氧化鈉常與無水碳酸鈉混合使用。用過氧化鈉作熔劑時有機物不能存在,否則極易發(fā)生爆炸。
參考資料:分析化學(xué)







