副反應系數和條件穩定常數(一)
發布時間:2017-09-01
在EDTA配位滴定法中,除了被測金屬離子M與滴定劑Y之間的主反應外,還可能存在下所示的副反應。
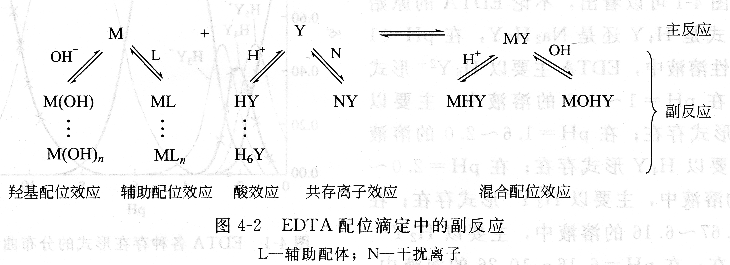
顯然,反應物M及Y的各種副反應不利于主反應的進行,生成物MY的副反應則有利于主反應的進行。由于酸式(MHY)、堿式(MOHY)配合物一般不太穩定,所以在有關的計算中,MY的副反應可以忽略不計。
為了定量討論副反應進行的程度,引入副反應系數a。下面分別討論M和Y的幾種重要的副反應和副反應系數。
一、EDTA的副反應及副反應系數
1、酸效廈及酸效厘系數
當M與Y發生配位反應時,如果有H+存在,就會與Y結合形成它的共軛酸,使Y的平衡濃度降低,主反應將受到影響。這種由于H+的存在使Y參加主反應能力降低的現象稱為酸效應。酸效應的大小用酸效應系數衡量,用aY(H)表示。酸效應系數表示在一定pH下,未參加配位反應的EDTA的各種存在形式的總濃度[Y’]與參加配位反應的Y的平衡濃度之比,即:
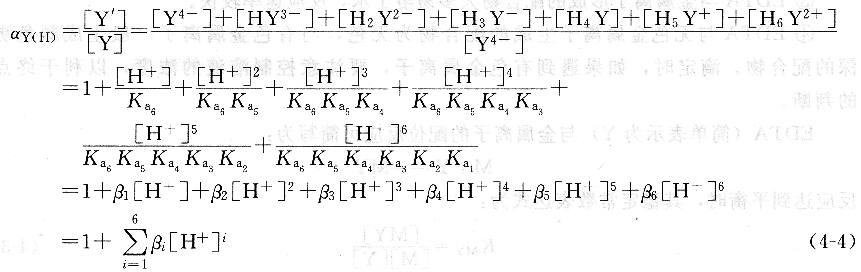
由上式可知,酸效應系數與EDTA的各級解離常數和溶液的酸度有關。在一定溫度下,aY(H)僅隨著溶液的酸度而變。溶液的酸度越大,pH越小,aY(H)越大,則酸效應引起的副反應越嚴重。否則,酸度越小,pH越大,aY(H)越小。當pH≥12時,aY(H)≈1,此時可以忽略酸效應的影響。
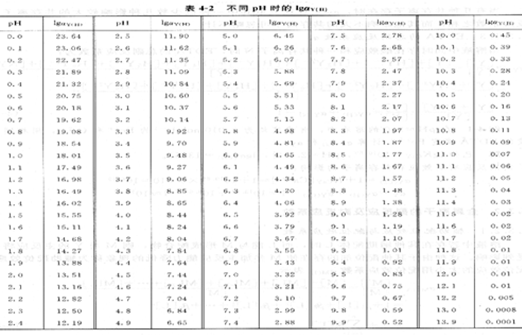
為了應用方便,將不同酸度下的aY(H),值列于表4―2。
二、共存離子效應及共存離子效應系數
除了金屬離子M與Y反應外,共存離子N也可能與Y發生副反應。由于配合物NY的生成,使Y的平衡濃度降低,從而影響Y參加主反應的能力。這種由共存離子引起的副反應稱為共存離子效應。共存離子效應的副反應系數稱為共存離子效應系數,用aY(N)表示。
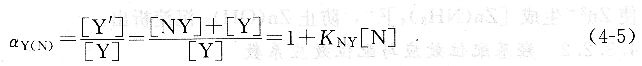
式中,KNY是配合物NY的穩定常數;[N]是游離的共存離子N的平衡濃度。若溶液中存在多種共存離子N1、N2、N3、…、NN,則:
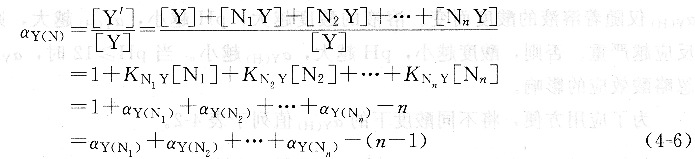
當有幾種共存離子存在時,aY(N)往往只取其中一種或少數幾種影響較大的共存離子副反應系數之和,而其他影響不大的共存離子可忽略不計。
2、 EDTA的總副反應系數aY,
當溶液中同時存在酸效應和一種共存離子N時,EDTA的總副反應系數為:
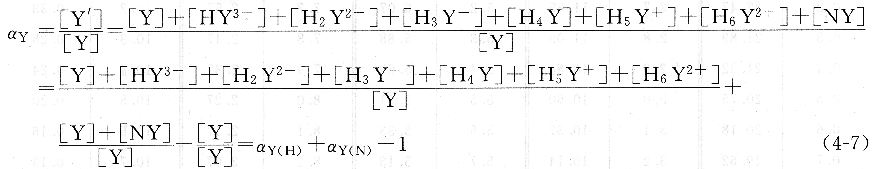
參考資料:分析化學







