副反應系數和條件穩定常數(二)
發布時間:2017-09-01
三、金屬離子的副反應及副反應系數
1、輔助配位效應與配位效應系數
溶液中若存在其他輔助配體L時,而L能與M形成配合物,則M與Y的主反應將會受到影響。這種由于其他配位劑的存在使M參加主反應能力降低的現象稱為輔助配位效應。
配位效應的大小用配位效應系數aM(L)表示。
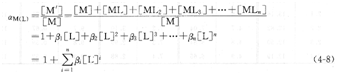
aM(L)越大,則金屬離子M與輔助配體L的副反應越嚴重。如果體系中金屬離子M沒有發生副反應,則aM(L)=1。附表7列出了部分金屬配合物的累積穩定常數。
在配位滴定中,配位劑L可能是滴定條件所需的緩沖劑或者是為了防止金屬離子水解所加的輔助配位劑,也可能是為了消除干擾而加入的掩蔽劑。例如,pH=10.0時,用EDTA滴定Zn2+,加入NH3-NH4Cl緩沖溶液,一是為了控制滴定所需要的pH,另一方面使Zn2+生成[Zn(NH3)4]2+,防止Zn(OH)2沉淀析出。
2、羥基配位效應與配位效應系數
在高pH值下滴定金屬離子時,金屬離子與OH一生成各種羥基化配離子,這種現象稱為金屬離子的羥基配位效應,也稱為金屬離子的水解效應,此時的羥基配位效應系數用aM(oH)表示。附表8中列出了部分金屬離子的aM(OH))值。
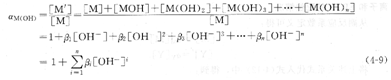
3、金屬離子的總副反應系數
若溶液中金屬離子存在以上兩類副反應:羥基配位效應和輔助配位效應,則金屬離子的總副反應系數可用aM表示。
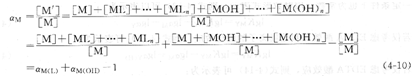
一般地,若溶液中有n個輔助配位劑能與金屬離子發生副反應,則M的總副反應系數aM為:
aM=aM(L1)+aM(L2)十…+aM(Ln)一(n-1)
上式中,L也可以代表OH-所參與的羥基配位效應。
四、條件穩定常數
在配位滴定法中,如果沒有副反應,溶液中M和EDTA的主反應進行的程度用穩定常數KMY表示。KMY值越大,形成的配合物越穩定。但是在實際反應中總會存在一些副反應,對主反應就會有不同程度的影響,KMY就不能客觀地反映主反應進行的程度。因此,需要對式(4―3)表示的配合物的穩定常數進行修正。若僅考慮EDTA的副反應(酸效應和共存離子效應)和金屬離子的配位效應的影響,則得到下式:
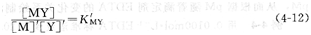
式中,[M]’和[Y]’分別表示M和Y的總濃度;K,MY稱為條件穩定常數,它是考慮了酸效應和配位效應后EDTA與金屬離子配合物的實際穩定常數。采用K’MY能更正確地判斷金屬離子和EDTA的配位情況。
從副反應系數定義可得:
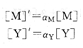
將上述關系式代入式(4―12)中,得到:
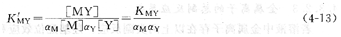
在一定條件下(如溶液的pH和試劑濃度一定時),aM和aY均為定值,因此,K’MY在一定條件下也為常數。用對數形式表示,則式(4 13)可以表示為:
lgK’MY二lgKMY―lgaM―lgaY
若僅考慮EDTA酸效應和金屬離子的配位效應,則式(4―14)可表示為:
LgK’MY=lgKMY―lgaM―lgaY(H)
若僅考慮EDTA酸效應,則式(4―14)可表示為:
LgK’MY=lgKMY―lgaY(H)
參考資料:分析化學







