多元酸、混合酸以及多元堿的滴定
發布時間:2017-09-01
1、多元酸的滴定
多元酸在水溶液中是分步解離的,其滴定反應也是分步進行的,例如用Na0H滴定二元酸H2A時有如下反應:
H2A+OH-=HA一+H20
HA一+OH-=A2-+H20
用強堿滴定多元酸時,情況比較復雜,既要考慮能否準確滴定,又要考慮能否分開滴定。與一元弱酸類似,cKa≥10-8就可以被準確滴定,至于能否分步滴定,取決于Ka1、Ka2的相對大小。若Ka1、Ka2相差不大,當第一步反應未進行完全時,第二步反應或多或少也要進行,即兩步反應有所交叉,這樣就不能形成兩個獨立的突躍,不能分步滴定。那么Ka1、Ka2相差多少才能分步滴定,這與分步滴定要求的準確度和檢測終點的準確度有關。由于在第一計量點的滴定產物HA-是兩性物質,具有緩沖作用,過量的堿不會造成溶液的pH大幅度升高,故此時的滴定突躍較一元弱酸(堿)的要小得多。因此,對多元酸分步滴定的準確度不能要求太高,當允許滴定誤差為±1%,滴定突躍≥0.4個pH單位,要進行分步滴定必須滿足下列條件:

因此,式(3―23)可作為多元弱酸分步滴定的判別式。例如,用0.10mol?L-1NaOH滴定同濃度的H3P04溶液。H3PO4在水中有三級離解:
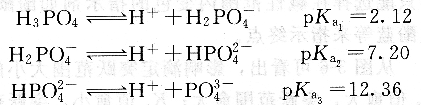
由于cKa1>10-9,Ka1/Ka2>104,cKa2>10-9,Ka2/Ka2>104,cKa3<10-9,因此H3PO4第一級和第二級解離H+均可準確直接滴定,且可分步滴定,而第三級解離H+不能直接滴定。NaOH滴定H3P04的滴定曲線見圖3―7,圖中有兩個明顯的滴定突躍。
由于要準確計算多元酸的滴定曲線,涉及比較麻煩的數學處理,下面我們僅討論化學計量點pH的計算和指示劑的選擇。
第一化學計量點時,溶液組成為NaH2P04,若按最簡式計算,將數據代入得pH1=4.66。
選擇甲基橙為指示劑,終點由紅變黃,分析結果的誤差約為一0.5%,在誤差允許范圍內。若選用甲基紅或溴甲酚綠作指示劑會更好。
第二化學計量點的產物為Na2HPO4,按最簡式計算,將數據代入得pH2=9.78。
若選用酚酞作指示劑,終點出現過早,有較大負誤差。使用百里酚藍作指示劑,終點顏色由無色變為淺藍色,結果的誤差約為+O.3%。
2、混合酸的滴定
混合酸有三種情況:兩種弱酸混合、強酸和強酸混合以及強酸和弱酸的混合。
①? 種弱酸(HA+HB)混合。這種情況與多元酸相似。如Ka(HA)>Ka(HB),允許誤差為1%,需c(HA)Ka(HA)≥10-9,可分步滴定HA。如果c(HB)Ka(HB)≥10-9,則較弱酸HB也可以被準確滴定。
②兩種強酸混合。用強堿滴定兩種強酸,不能分別滴定,但可以測定兩種強酸的總量。
③強酸和弱酸的混合。其情況比較復雜,這里不作詳細討論。
3、多元堿的滴定
多元堿滴定的處理方法與多元酸相似,只需將相應計算公式、判別式中的Ka換成Kb即可。
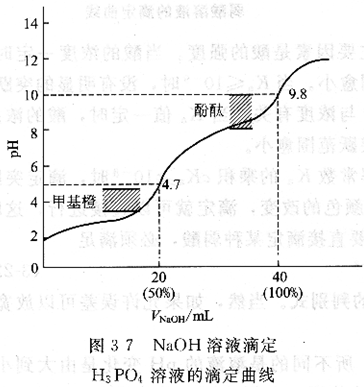
例如用0.10m01?L-1HCl溶液滴定同濃度的Na2C03溶液。Na2C03是二元弱堿,在水溶液中分兩步離解:
![]()
由于cKb1>10-9,cKb2=0.1×2.2×10-8=2.2 ×10-9,Kb1/Kb2≈104,可準確分步滴定到第二步,即H2CO3,又因為HCO-3的緩沖作用,第一個滴定突躍不明顯。第二個滴定突躍雖然較第一個明顯些,但滴定突躍仍然較小。其滴定曲線見圖3-8。
在第一化學計量點,產物為NaHCO3。
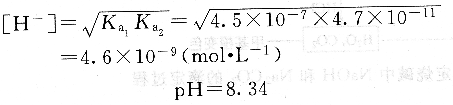
可選用酚酞為指示劑,但終點顏色較難判斷(紅~微紅或無色),誤差可大于1%。若選用甲酚紅與百里酚藍混合指示劑(變色的pH值范圍為8.2~8.4,顏色粉紅~紫),并使用同濃度NaHC03溶液作參比,終點誤差可減少到0.5 %。
第二化學計量點時產物為H2C03(C02+H20),飽和溶液的濃度約為O.04mo1?L -1。則:

可選用甲基橙作指示劑。由于滴定時易形成CO2的過飽和溶液,致使溶液的酸度稍稍增大,終點出現過早。因此快到終點時,應劇烈地搖動溶液,必要時可加熱煮沸溶液以除去C02,冷卻后再繼續滴定至終點,也可使用參比溶液進行對照。
參考資料:分析化學







