首頁(yè)>技術(shù)中心>技術(shù)資訊>沉淀滴定法概述
沉淀滴定法概述
發(fā)布時(shí)間:2017-09-01
一、沉淀滴定法及分類
沉淀滴定法是以沉淀滴定反應(yīng)為基礎(chǔ)的滴定分析方法。
沉淀反應(yīng)很多,但是能用于滴定分析的沉淀反應(yīng)必須符合下列條件:
(1)反應(yīng)按一定的化學(xué)計(jì)量關(guān)系進(jìn)行,生成沉淀的溶解度必須很小。對(duì)于1∶1型的沉淀,其Ksp≤10-10;
(2)反應(yīng)速度要快,不易形成過(guò)飽和溶液;
(3)有確定化學(xué)計(jì)量點(diǎn)的簡(jiǎn)單方法;
(4)沉淀的吸附現(xiàn)象不影響測(cè)定結(jié)果。
由于上述條件的限制,能用于沉淀滴定法的反應(yīng)并不多。目前常用的是生成難溶性銀鹽的“銀量法”,如:

用銀量法可測(cè)定Cl一,Br-,I-,SCN和Ag+等以及一些含鹵素的有機(jī)化合物。
除銀量法以外,還有利用其他沉淀反應(yīng)的滴定分析法。如K4[Fe(CN)6]與Zn2+,四苯硼酸鈉與K+,Ba+與SO42-形成沉淀的反應(yīng)都可用于沉淀滴定法。
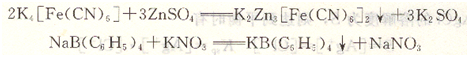
本章主要討論銀量法。根據(jù)滴定方式的不同,銀量法又可分直接滴定法和返滴定法。直接滴定法是用AgNO。標(biāo)準(zhǔn)溶液直接滴定待測(cè)組分。返滴定法是向待測(cè)試液中加入一定量的過(guò)量AgNO3標(biāo)準(zhǔn)滴定溶液,在用NH4SCN標(biāo)準(zhǔn)滴定溶液滴定剩余的AgNO3溶液。
根據(jù)終點(diǎn)所采用的指示劑不同,銀量法分為莫爾法、佛爾哈德法和法揚(yáng)司法。
二、溶度積原理及應(yīng)用
1、溶度積原理
在一定溫度下,難溶化合物MmAn,在其飽和溶液中各離子濃度自乘之積是一個(gè)常數(shù),稱為溶度積常數(shù),簡(jiǎn)稱溶度積,用Ksp表示。如:MmAn在其飽和溶液中有如下平衡:
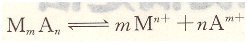
溶度積表達(dá)式為:
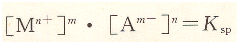
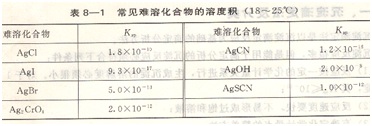
Ksp數(shù)值的大小與物質(zhì)的溶解度和溫度有關(guān),它反映了難溶化合物的溶解能力。沉淀滴定中,常用的溶度積如表8―1所示。
應(yīng)當(dāng)指出,溶度積嚴(yán)格地說(shuō)應(yīng)以離子活度的乘積(簡(jiǎn)稱活度積)Qap來(lái)表示。在分析化學(xué)中,由于難溶化合物的溶解度一般很小,溶液中的離子強(qiáng)度不大,離子活度近似為1,故通常不考慮離子強(qiáng)度的影響。若溶液中的離子強(qiáng)度較大,則必須考慮離子強(qiáng)度的影響。
2、溶度積原理的應(yīng)用
(1)利用溶度積求難溶化合物的溶解度。
參考資料:分化化學(xué)







