其他氧化還原滴定法
發布時間:2017-09-01
1、硫酸鈰法
硫酸高鈰Ce(S04):是一種強氧化劑,在酸性溶液中,Ce4+與還原劑作用,被還原為Ce3+,其半反應如下:
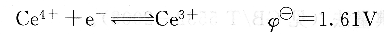
Ce4+/ Ce3+的條件電極電勢決定于酸的濃度和種類(見附表11)。酸的種類和濃度不同,其條件電極電勢相差較大。原因是,在HclO4中Ce4+不形成配合物,在其他酸中Ce4+都可能與相應的陰離子(如Cl-和SO2-4等)形成配合物。在HCl介質中,Cl-還可使Ce4+緩慢地還原為Ce3+,所以在分析上,常采用Ce(SO4)2溶液作滴定劑。在H2SO4介質中,Ce(S04)2的條件電勢值介于KMn04與K2Cr2 07之間,能用KMn04法測定的物質,一般也能用硫酸鈰法測定。與KmnO4法相比,硫酸鈰法具有下列優點。
①Ce(SO4)2溶液穩定,放置較長時間或加熱煮沸也不易分解。
②可由容易提純的Ce(S04)2?(NH4)2S04?2H20直接配制標準溶液。
③能在較大濃度的HCl介質中滴定還原劑Fe2+;雖然Cl-能還原Ce4+,但滴定時Ce4+首先與Fe2+反應,達到化學計量點后,Ce4+才緩慢地與Cl一起反應,故不影響滴定。
④Ce4+還原為Ce3+時,只有一個電子的轉移,不生成中間價態的產物,反應簡單,副反應少。如有多種有機物(如乙醇、甘油、糖等)存在時,用Ce4+滴定Fe2+仍可得到滿意的結果。
⑤Ce(S04)2溶液呈橙黃色,Ce3+無色,故用Ce(S04)2滴定無色溶液時,可用其自身作指示劑,但靈敏度不高。在熱溶液中滴定時,終點變色較明顯。故一般仍采用鄰二氮雜菲-亞鐵作指示劑,終點時變色敏銳,效果更好。
注意:在酸度較低時(1m019?L-1),磷酸有干擾,可能生成磷酸高鈰沉淀。Ce4+易水解,生成堿式鹽沉淀,所以Ce4+不適用于堿性或中性溶液中滴定。
2、溴酸鉀法
溴酸鉀法是用KBr03作氧化劑的滴定方法。KBr03在酸性溶液中是一種強氧化劑,其電極反應為:
![]()
KBr03容易提純,在180℃烘干后,可以直接配制標準溶液。但由于KBr03本身和還原劑的反應進行得很慢,實際上是在配制KBr03標準溶液時加入過量KBr(或在滴定前加入KBr),當溶液酸化時,BrO-3即氧化Br一而析出游離Br2,反應為:
BrO-3+5Br一+6H+=3Br2+3H2O
實際上KBr03標準溶液相當于溴(Br2)標準溶液,![]()
由于溴水不穩定,不適合配制標準溶液作滴定劑,而KbrO3-KBr的溶液很穩定,只有在酸化時才發生上述反應。這就像即時配制的溴(Br2)標準溶液一樣。游離Br2能氧化還原性物質。
KBr03-KBr標準溶液,也可用碘量法進行標定,其原理就是溴酸鉀法與碘量法的配合使用。即在酸性溶液中,以淀粉作指示劑,一定量的KbrO3與過量的KI作用析出12,其反應如下:
BrO-3+6I一+6H+=Br-+312+3H2O
也可表示為 BrO-3+5Br-+6H+=3Br2+3H20
Br2+2I一=2Br-+I2
析出的12,再用Na2S203標準溶液滴定之。
溴酸鉀法分直接法和間接法。間接法就是溴酸鉀法與碘量法配合使用的實例,即用過量的KBr03標準溶液在酸性溶液中與待測物質作用,剩余的KBr03與過量KI作用,析出游離I2,再用Na2S203標準溶液滴定。
溴酸鉀法主要用于測定苯酚含量。通常在苯酚的酸性溶液中加入過量的KBr03-KBr標準溶液,生成的Br2可取代苯酚中的氫:
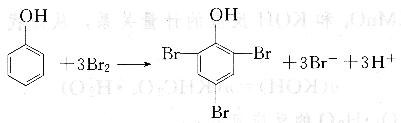
過量的Br2用KI還原。
析出游離I2,用Na2S203標準溶液滴定,以淀粉作指示劑。根據反應中的計量關系可求得苯酚的質量分數。
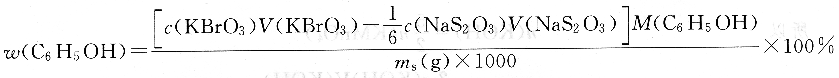
KbrO3法也可用來直接測定一些能與KBr03迅速起反應的物質。例如:礦石中銻含量的測定。具體測定過程為,先將礦樣溶解,再使Sb(V)→Sb(Ⅲ),然后在HCl溶液中用KBr03標準溶液滴定Sb(Ⅲ),甲基橙作指示劑,終點時過量一滴KBr03可氧化指示劑,使甲基橙褪色,以指示終點的到達。

此法還可用來直接測定As(Ⅲ)、Sn(Ⅱ)、TI(I)等。
3、亞砷酸鈉-亞硝酸鈉法
亞砷酸鈉-亞硝酸鈉法是使用Na3AsO3-NaNO2混合溶液進行滴定,可用于普通鋼和低合金鋼中錳的測定。
試樣用酸分解,錳轉化為Mn2+,以AgN03作催化劑,用(NH4)2S208將Mn2+氧化為MnO-4,然后用Na3As03-NaN02的混合溶液進行滴定,反應如下:
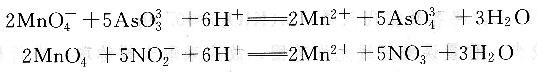
單獨用Na3As03溶液滴定Mn0-4,在H2S04介質中,Mn(Ⅶ)只被還原為平均氧化值為3.3的錳。而單獨用NaN02溶液滴定Mn0-4,在酸性介質中,Mn(Ⅶ)可定量地還原為Mn(Ⅱ),但HN02和Mn0-4作用緩慢,而且HNO2不穩定。為此,采用Na3 As03一NaN02的混合溶液來滴定Mn0-4。此時N0-2能使Mn0-4定量還原為Mn2+,AsO3-3能加速反應進行。測定結果也較準確。即使如此,仍不能按理論值計算,需要已知含錳量的標準試樣來確定Na3As03一NaN02混合溶液對錳的滴定度。
參考資料:分析化學







