配位滴定法――概述(一)
發布時間:2017-09-01
以形成配位化合物的反應為基礎的滴定分析方法稱為配位滴定法。目前,采用配位劑直接和間接測定金屬元素的方法,已經日益廣泛。本章著重討論EDTA配位滴定的反應條件、指示劑及有關的基礎知識。
一、配位化合物
由一個簡單陽離子和幾個中性分子或其他離子以配位鍵相結合而形成的復雜離子叫做配位離子,含有配位離子的鹽叫做配位化合物(簡稱配合物)。例如K4[Fe(CN)6],NH4[Cr(NH3)2(cNS)4],[Cu(NH3)4]SO4等都是配位化合物。
配位化合物一般可以分為內界和外界兩個組成部分,內界稱為配位離子。它由中心離子和配位體組成,位于配位離子中心的帶有正電荷的離子稱中心離子,它是配位離子的形成體。中心離子絕大多數是金屬離子,如Fe2+,Cr3+,Cu2+,Pb2+,Mg2+等。同中心離子結合的中性分子或離子稱為配位體,如:NH3,CN一,CNS-,一COOH,H2O等都是配位體。在配位體中直接和中心離子配位鍵相結合的原子稱配位原子,如NH3中的氮原子、CN一中的氮原子、H2O中的氧原子、一COO*H中帶*號的氧原子,都是配位原子。
如:以NH4[Cr(NH3)2(CNS)4]為例說明配位化合物的結構。

與中心離子相結合的配位原子的總個數,叫做中心離子的配位數。
中心離子Cr3+的配位數為2個NH3分子中的氮原子加4個CNS-中的氮原子,總個數為6。一個配位體中具有兩個以上的原子直接和中心離子以配位鍵相結合,則這配位體稱多基配位體。如,Ni2+與乙胺配位化合時,乙二胺中有2個配位原子和中心離子Ni2+結合,所形成環狀配位化合物稱為螯合物,又叫內配位化合物。
配位化合物中配位原子和中心離子之間的配位鍵用符號“→”表示,說明配位鍵的孤對電子由配位原子提供,配位原子和中心離子共用。
螯合物的環上有幾個原子,就被稱為幾原子環的螯合物。如:
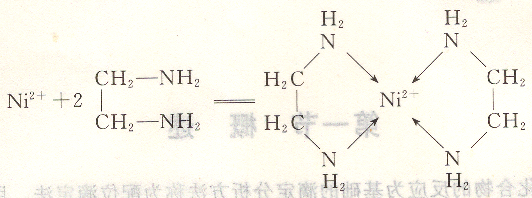
螯合物環上有5個原子,所以稱5原子環。螯合物由于有環狀結構,比簡單配位化合物的穩定性大得多,其中5原子環和6原子環最穩定。同時,由于螯合結構很少有分級解離的現象,因此,此類配位化合物目前在分析化學中是應用最廣的。
二、配位滴定反應必須具備的條件
(1)配合反應必須迅速,并生成足夠穩定的配位化合物;
(2)反應必須按一定的化學反應式定量地進行,即生成配位數固定的配合物;
(3)要有適當的方法來指示或確定終點,如硝酸銀和氰化物的配合反應:

反應能迅速形成穩定的[Ag(CN)2]一配位離子,能定量地形成固定的配位數為2的配合物,當達到等量點時,稍過量的Ag+就會與[Ag(CN)2]一配位離子結合形成Ag[Ag(CN)2]白色沉淀,從而確定終點。其反應為:
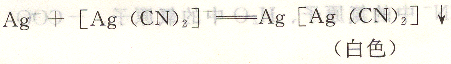
故此反應符合配位滴定對反應的要求,可采用硝酸銀標準溶液滴定溶液中的氰化物,根據硝酸銀標準溶液用量來計量氰化物的含量。
參考資料:分析化學







