首頁>技術(shù)中心>技術(shù)資訊>配位滴定法――概述(二)
配位滴定法――概述(二)
發(fā)布時(shí)間:2017-09-01
三、配位劑的類型
能和簡單陽離子形成配位化合物的物質(zhì)稱為配位劑。常見的配位劑分為無機(jī)配位劑和有機(jī)配位劑。
1、 無機(jī)配位劑
大多數(shù)無機(jī)配位劑和金屬離子形成的配位化合物穩(wěn)定性不強(qiáng),而且存在分步配合,穩(wěn)定常數(shù)相近不易區(qū)分的缺點(diǎn)。同時(shí),滴定時(shí)溶液中沒有金屬離子濃度變化的突躍,無法確定終點(diǎn),因而不符合配位滴定反應(yīng)的條件。除少數(shù)幾種配位劑,如氰化物、硫氰化物可與幾種金屬離子,如Ag+,Mg2+和Ni2+配合外,大部分無機(jī)配位劑都不能滿足配位滴定的要求。
2、有機(jī)配位劑
有機(jī)配位劑可以和金屬離子形成很穩(wěn)定的螯合物,配合反應(yīng)能夠滿足上述條件,因而被廣泛應(yīng)用到配位滴定中。目前應(yīng)用最普遍的有機(jī)配位劑是一類含有氨基二乙酸基團(tuán)的氨羧配位劑。其中最常見的是乙二胺四乙酸(簡稱EDTA):
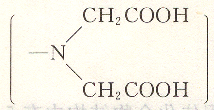
結(jié)構(gòu)式為:
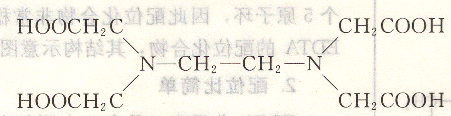
簡寫成H4Y。它為白色結(jié)晶粉末,無毒無臭,具有酸味。由于EDTA在水中溶解度很小(室溫時(shí)約為0.02g/100g),因此,通常用它的二鈉鹽,即乙二胺四乙酸二鈉鹽。
乙二胺四乙酸二鈉鹽含2分子結(jié)晶水,在水中溶解度較大,室溫下飽和水溶液的濃度約為O.3 mol/L。其結(jié)構(gòu)式為:
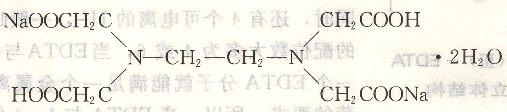
仍簡稱為EDTA,簡寫式為Na2H2Y?2H2O相對分子質(zhì)量為372.24。
除此以外,還有其他氨羧配位劑,如乙二胺四丙酸(簡稱EDTP),結(jié)構(gòu)式為:
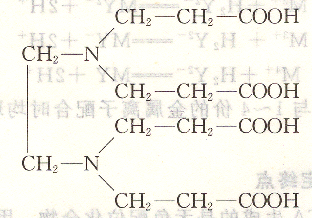
乙二醇二乙醚二胺四乙酸(簡稱EGTA),結(jié)構(gòu)式為:
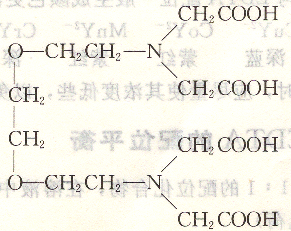
二乙基三胺五乙酸(DTPA)、三乙基四胺六乙酸(TTHA)等。不同的配位劑與金屬離子形成配位化合物,穩(wěn)定性有時(shí)差別較大,故可以用來提高滴定某些金屬離子的選擇性。
參考資料:分析化學(xué)







