首頁>技術(shù)中心>技術(shù)資訊>沉淀滴定法――法揚(yáng)司法
沉淀滴定法――法揚(yáng)司法
發(fā)布時(shí)間:2017-09-01
用吸附指示劑指示終點(diǎn)的銀量法稱為法揚(yáng)司法。
一、原理
吸附指示劑是在沉淀表面上發(fā)生顏色改變的指示劑,它一般是有色的有機(jī)弱酸。吸附指示劑不是在溶液中變色,而是由于膠體沉淀表面帶正電荷時(shí),指示劑的酸根陰離子被吸附在膠體微粒表面而發(fā)生分子結(jié)構(gòu)的變化,從而發(fā)生顏色的改變。
如,用AgNO3標(biāo)準(zhǔn)溶液滴定Cl-時(shí),采用熒光黃作指示劑。熒光黃是一種有機(jī)弱酸。可用HFIn表示,它的離解如下:
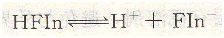
在計(jì)量點(diǎn)前,溶液中存在過量的C1一,AgCl沉淀吸附C1-而帶負(fù)電荷形成AgCl?Cl一,熒光黃的陰離子不被吸附,溶液呈現(xiàn)Fin一的黃綠色。當(dāng)?shù)味ǖ接?jì)量點(diǎn)時(shí),過量1滴的AgNO3即可使AgCl因吸附Ag+而帶正電荷,形成AgCl?Ag+,它強(qiáng)烈的吸附Fin-。熒光黃陰離子被吸附后,結(jié)構(gòu)發(fā)生變化,使沉淀表面呈現(xiàn)粉紅色,從而指示滴定終點(diǎn)。
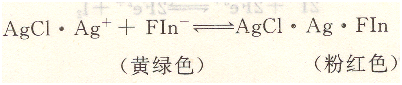
用AgNO3作標(biāo)準(zhǔn)溶液時(shí),常見的幾種吸附指示劑的使用條件參見表8―2。

二、滴定條件
(1)由于吸附指示劑是吸附在沉淀表面上而變色的,為了使終點(diǎn)變色更明顯,就必須使沉淀有較大的表面積,這就需要把AgCl沉淀保持膠體狀態(tài)。因此,滴定時(shí)一般先加入糊精或淀粉溶液等親水性的高分子化合物作為膠體保護(hù)劑。
(2)滴定必須在中性、弱酸性或弱堿性溶液中進(jìn)行。這是因?yàn)樗岫容^高時(shí)指示劑陰離子濃度小,不易為正電溶膠所吸附。酸度較低時(shí),除了可以形成Ag2O沉淀外,指示劑的電離過強(qiáng),可能在計(jì)量點(diǎn)之前就被吸附,使終點(diǎn)提前。至于合適的酸度范圍與指示劑的離解常數(shù)的大小有關(guān),離解常數(shù)越大,酸性可以強(qiáng)一些,如熒光黃Ka≈10-7,適宜的酸度范圍為pH=7~lO,二氯熒光黃Ka≈10-4,適宜的酸度范圍為pH=4~10,曙紅(四溴熒光黃,Ka≈10-2),適宜的酸度范圍為pH=2~10。
(3)因鹵化銀易感光變黑,影響終點(diǎn)觀察,所以應(yīng)避免在強(qiáng)光下滴定。
(4)被測離子的濃度不能太稀。因?yàn)闈舛忍r(shí),生成的沉淀量很少,觀察終點(diǎn)比較困難。如以熒光黃作指示劑,用AgNO3標(biāo)準(zhǔn)溶液滴定Cl一時(shí),要求[C1-]>0.005mol/L,但測定Br一,I一和SCN-時(shí),其靈敏度較高,濃度低至0.001mol/L時(shí)仍可準(zhǔn)確測定。
(5)膠體微粒對(duì)指示劑陰離子的吸附能力應(yīng)略小于對(duì)被測離子的吸附能力,否則將在計(jì)量點(diǎn)前變色。但其也不能太小,否則使終點(diǎn)推遲。鹵化銀對(duì)鹵離子及吸附指示劑的吸附能力的次序?yàn)?








