氧化還原滴定法――高錳酸鉀法
發布時間:2017-09-01
一、概述
高錳酸鉀是一種氧化劑。在強酸性溶液中,KmnO4與還原劑作用時獲得5個電子,還原為Mn2+。
![]()
在中性或堿性溶液中獲得3個電子,還原為MnO2。
![]()
由此可見,高錳酸鉀法既可在酸性條件下使用,也可在中性或堿性條件下使用。由于KmnO4在強酸性溶液中具有更強的氧化能力,生成的Mn2+不干擾終點的觀察,因此一般在強酸性溶液中使用。所用的強酸一般為H2sO4,避免使用HCl和HNO3,因為Hcl中Cl-具有還原性,在一定條件下也能與KmnO4作用,而HNO3具有氧化性,它可能氧化某些被滴定的物質。但KmnO4在堿性條件下氧化有機物的反應速度比在酸性條件下更快。在NaOH濃度大于2m01.L-1的堿溶液中,很多有機物與KmnO4反應,此時MnO4-被還原為MnO42+。
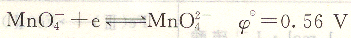
用KmnO4作氧化劑,可直接滴定許多還原性物質,如Fe(Ⅱ)、H2O2、草酸鹽、As(Ⅲ)、Sb(Ⅲ)、W(V)、及U(Ⅳ)等。
有些氧化性物質不能用KmnO4溶液直接滴定,可用問接法測定。例如測定MnO2的含量時,可在試樣的H2SO4溶液中加入一定過量的Na2C2O4,待MnO2與C2O42-作用完畢后,用KmnO4標準溶滴定過量的C2O42-。利用類似的方法,還可測定PbO2,Pb3O4,K2Cr2O7,KclO3以及H3VO4等氧化劑的含量。
某些物質雖不具氧化還原性,但能與另一還原劑或氧化劑定量反應,也可以用間接法測定。如,測定Ca2+時,先將Ca2+沉淀為CaC2O4,再用稀H2SO4將所得沉淀溶解,然后用KmnO4標準溶液滴定溶液中的C2O42-,從而間接求得Ca2+的含量。顯然,凡是能與C2O42-定量地沉淀為草酸鹽的金屬離子(如Sr2,Ba2+,Ni2+,Cd2+,Zn2+,Cu2+,Pb2+,Hg2+,Ag+,Bi3+,Ce3+,Ce3+,La3+等)都能用同樣的方法測定。
高錳酸鉀法的優點是KmnO4氧化能力強,應用廣泛。但由于其氧化能力強,可以和很多還原性物質發生作用,所以干擾也比較嚴重。此外,KmnO4試劑常含少量雜質,其標準溶液不夠穩定。
二、高錳酸鉀標準溶液
市售的高錳酸鉀常含有少量的雜質,如硫酸鹽、氯化物及硝酸鹽等,因此不能用直接法配制準確濃度的標準溶液。KmnO4氧化力強,易和水中的有機物、空氣中的塵埃、氨等還原性物質作用。KmnO4還能自行分解,如下式所示:
![]()
分解的速度隨溶液的pH而改變,在中性溶液中分解很慢,但Mn2+和MnO2的存在能加速其分解,見光時分解得更快,因此KmnO4溶液的濃度容易改變。
為了配制較穩定的KmnO4溶液,需采用以下方法:
①可稱取稍多于理論量的KmnO4固體,溶于一定體積的蒸餾水中。
②加熱煮沸,并保持微沸1 h,冷卻后貯于棕色瓶中,于暗處放置數天,使溶液中可能存在的還原性物質完全氧化。
③用微孔玻璃漏斗過濾以除去析出的MnO2沉淀,再進行標定。使用久置的KmnO4溶液時應重新標定其濃度。
KmnO4溶液可用還原劑作基準物來標定。H2C2O4?2H2O,Na2C2O4,FeSO4.(NH4)2SO4?6H2O,純鐵絲及As2O3等都可用作基準物。其中草酸鈉不含結晶水,容易提純,是最常用的基準物質。
在H2SO4溶液中,Mn04-與C2O42-的反應為:
![]()
為了使此反應能定量地、較迅速地進行,應注意下述滴定條件。
(1)溫度
在小于600C時,此反應的速度緩慢,因此應將溶液加熱至75~850C;但溫度如超過900C,在酸性溶液中會使部分H2C2O4發生分解。
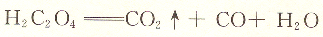
(2)酸度
溶液保持足夠的酸度,一般在開始滴定時,溶液的酸度約為0.5~1 m01?L-1,滴定終了時酸度約為0.5 mol?L-1。酸度不夠時,往往容易生成MnO2沉淀,酸度過高又會促使H2C2O4分解。
(3)滴定速度
由于Mn04-與C2O42-的反應是自動催化反應,滴定開始時,加入的第一滴KmnO4溶液已起作用后,滴定速度就可以稍快些,但不能讓KmnO4溶液來不及與C2O42-反應,即在熱的酸性溶液中發生分解。
![]()
(4)KmnO4法滴定終點是不太穩定的,這是由于空氣中的還原性氣體及塵埃等雜質落入溶液中能使KmnO4緩慢分解,而使粉紅色消失,所以經過O.5 min不褪色即可認為終點已到。
(5)應用酸式滴定管,用完及時清洗。
三、應用示例
1、過氧化氫的測足
商品雙氧水中的過氧化氫,可用KmnO4標準溶液直接滴定,其反應為:
![]()
該滴定過程可在室溫時于硫酸或鹽酸介質中順利進行,但開始時反應進行較慢,反應產生的Mn2+可起催化作用,使以后的反應加快。
H2O2不穩定,在其工業品中一般加入某些有機物如乙酰苯胺等作穩定劑。這些有機物大多能與Mn04-作用而干擾H 202的測定。此時過氧化氫宜采用碘量法或硫酸鈰法測定。
2、鈣的測定
某些金屬離子能與C2042-生成難溶草酸鹽沉淀,如果將生成的草酸鹽沉淀溶于酸中,然后用KmnO4溶液來滴定C2042-,就可間接測定這些金屬離子。鈣離子的測定就可采用此法。
在沉淀Ca2+時,為了獲得顆粒較大的晶形沉淀,并保證Ca2+=與C2O42-有1∶1的關系,必須選擇適當的沉淀條件。通常是在Ca2+試液中先加鹽酸酸化,再加入(NH4)2C2O4。由于C2O42-在酸性溶液中大部分以HC2O4-形式存在,C2042-的濃度很小,此時即使Ca2+濃度相度相當大,也不會生成CaC2O4沉淀。向加入(NH4)2C2后的溶液中滴加稀氨水,由于H+逐漸被中和,C2042-濃度緩緩增加,就可以生成粗顆粒結晶的CaC2O4沉淀。最后應控制溶液的pH在3.5~4.5之問(甲基橙顯黃色)并繼續保溫約30 min使沉淀陳化。這樣不僅可以避免Ca(OH)2或(CaOH)2C2O4沉淀的生成,而且所得CaC2O4溶于稀硫酸中,即可用KmnO4標準溶液滴定熱溶液中與Ca2+定量結合的C2O42-。
3、鐵的測定
用KmnO4溶液滴定Fe2+,以測定礦石(例如褐鐵礦等)、合金、金屬鹽類及硅酸鹽等試樣中的含鐵量,有很大的實用價值。
試樣溶解后(通常使用鹽酸作溶劑)生成的Fe2+(實際上是FeCl4-,FeCl63-等配離子),應先用還原劑使之還原為Fe2+,然后用KMn4標準溶液滴定。常用的還原劑是SnCl2(也有用Zn,A1,H2S,SO2及汞齊等作還原劑的),多余的SnCl2可以借加入HgCl2而除去。

不過,HgCl2有劇毒,為了避免對環境的污染,近年來采用了各種不用汞鹽的測定鐵的方法。
在以KmnO4溶液滴定前還應加入硫酸錳、硫酸及磷酸的混合液,其作用是:
(1)避免Cl-存在下發生的誘導反應。
(2)由于滴定過程中生成黃色的Fe3+,達到終點時,微過量的KmnO4所呈現的粉色將不易分辨,以致影響終點的正確判斷。在溶液中加入磷酸后,PO43-與Fe3+生成無色的Fe(PO4)23-配離子,就可使終點易于觀察。
4、有機物的測定
在強堿性溶液中,過量KmnO4能定量地氧化某些有機物。例如KmnO4與甲酸的反應為:
![]()
待反應完成后,將溶液酸化,用還原劑標準溶液(亞鐵離子標準溶液)滴定溶液中所有的高價態的錳,使之還原為Mn(Ⅱ),然后計算出消耗的還原劑的物質的量。用同樣方法測出反應前一定量堿性KmnO4溶液相當于還原劑的物質的量,根據二者之差即可計算出甲酸的含量。
用此法還可測定葡萄糖、酒石酸、檸檬酸、甲醛等的含量。
5、水樣中化學耗氧量(COD)的測定
COD是量度水體受還原性物質污染程度的綜合性指標,它是指水體中還原性物質所消耗的氧化劑的量,換算成氧的質量濃度(以mg?L-1計)。測定時在水樣中加入H2SO4及一定量過量的KmnO4溶液,置沸水浴中加熱使其中的還原性物質氧化。用一定過量的Na2C4O4溶液還原剩余的KmnO4溶液,再以KmnO4的標準溶液返滴定剩余的Na2C2O4溶液。本法適用于地表水、地下水、飲用水和生活污水中COD的測定。反應式為:
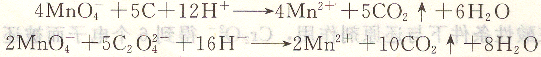
由于C1一對此法有干擾,因此含Cl-高的工業廢水中COD的測定應采用K2Cr2O7法。
參考資料:分析化學







