混合離子的分別滴定(一)
發布時間:2017-09-01
在實際工作中,分析對象常常比較復雜,在被滴定的溶液中可能存在多種金屬離子,EDTA滴定時可能互相干擾,因此,在混合離子中如何滴定某一種離子或分別滴定某幾種離子是配位滴定中需要解決的重要問題。
1、控制酸度進行分別滴定
當滴定單一金屬離子時,只要滿足lgcK’MY≥6的條件,就可以準確進行滴定,此時相對誤差≤±0.1%。但是當溶液中存在兩種或兩種以上的金屬離子時,就不能使用式(4-18) 判斷滴定的準確性。
若溶液中僅含有金屬離子M和N,它們均與EDTA形成配合物,欲測定M的含量,需考慮共存離子N是否對M的測定產生干擾,即需要考慮干擾離子N的副反應,其副反應系數為aY(N)。當KMY>KNY,且aY(N)》aY(H),可推導出下式:
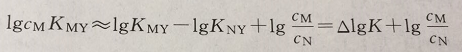
即兩種金屬離子配合物的穩定常數差值△lgK越大,被測金屬離子濃度cM越大,干擾離子濃度cN越小,則在N存在下準確滴定M的可能性就越大。那么△lgK要相差多大才能分別滴定?這取決于滴定時所要求的準確度及終點和化學計量點之間pM的差值△pM等因素。
對于有干擾離子存在的配位滴定,一般允許有≤±0.5%的相對誤差,當用指示劑檢測終點△pM≈O.3時,應使lgcMK’MY≥5,則:
△lg(cK)=5
當cM=cN時,則:
△lgK=5
故作為判斷能否利用控制酸度進行分別滴定的條件。
如,Bi3+、Pb2+混合溶液中,其濃度均為0.Olmol?I-1,用EDTA滴定Bi3+。
查表可知,lgKBiY=27.94,lgKPbY=1 8.04,則△lgK=27.94―1 8.04=9.9>5,符合要求。因此可以選擇滴定Bi3+而Pb2+不干擾。根據酸效應曲線可查出滴定Bi3+的最低pH約為O.7,但滴定時pH也不能太大,因在pH≈2時,Bi3+開始水解析出沉淀。因此滴定Bi3+的適宜pH范圍為0.7~2。在實際操作中,選取pH≈1時進行滴定,以保證滴定時Bi3+不會析出水解產物,Pb2+也不會干擾Bi3+與EDTA的滴定。
因此,當溶液中有兩種以上金屬離子共存時,能否分別滴定應首先判斷各組分在測定時有無相互干擾,若△1g(cK)足夠大,則相互無干擾,這時可以通過控制酸度依次測定各金屬離子的含量。
具體步驟如下:
①判斷混合物中各組分離子與EDTA形成配合物的穩定常數的大小,KMY值最大的金屬離子首先被滴定。
②根據式中判斷KMY值最大的金屬離子和與其相鄰的另一種金屬離子之間有無干擾。
③若無干擾,則計算確定KMY值最大的金屬離子被滴定的適宜pH范圍,選擇合適的指示劑,用EDTA進行滴定;其他離子的測定以此類推。
④若有干擾,則不能直接滴定,需采取掩蔽、分離等方法去除干擾離子后再進行測定。
2、掩蔽和解蔽
若被測金屬的配合物與干擾離子的配合物的穩定性相差不夠大(AlgK小),甚至lgKMY比lgKNY還小,就不能用控制酸度的方法進行分別滴定。若加入一種試劑與干擾離子N反應,則溶液中N的濃度降低,N對M的干擾作用也就減小或消除。這種方法稱為掩蔽法,所加入的試劑稱為掩蔽劑。
按照掩蔽方法的不同,可以分為配位掩蔽法、沉淀掩蔽法和氧化還原掩蔽法等,其中以配位掩蔽法用得最多。
3、配位掩蔽法
利用掩蔽劑和干擾離子N能形成穩定的配合物,降低溶液中干擾離子濃度,從而達到選擇滴定金屬離子M的目的。具體方法如下:
① 加入配位掩蔽劑L,再用EDTA滴定M。例如,溶液中含有A13+和Zn2+,則先在酸性溶液中加入過量F-,調節pH 5~6,使A13+生成[A1F6]3一后,再用EDTA準確滴定Zn2+、A13+不干擾。
②先加入配位掩蔽劑,使干擾離子N生成配合物NL,用EDTA準確滴定M,然后使用另一種試劑X破壞NL,從NL中將N釋放出來,再用EDTA準確滴定N,這種作用稱為解蔽,所加入的試劑X起了消除掩蔽劑的作用,故稱X為解蔽劑。例如,銅合金中Cu2+、Zn2+和pb2+三種離子共存,欲測定其中Zn。+和Pb抖,用氨水中和試液,加入KCN掩蔽Cu2+和Zn2+,在Ph=1 0時,用鉻黑T作指示劑,用EDTA滴定pb2+。滴定后的溶液,加入甲醛或三氯乙醛作解蔽劑,破壞[Zn(CN)4]2-配離子:
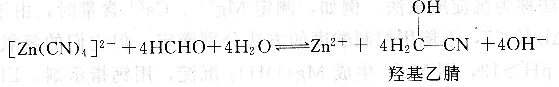
釋放出來的Zn2+,再用EDTA繼續滴定。[Cu(cN)4]2-比較穩定,不易解蔽,但是若甲醛濃度較大時會發生部分解蔽。
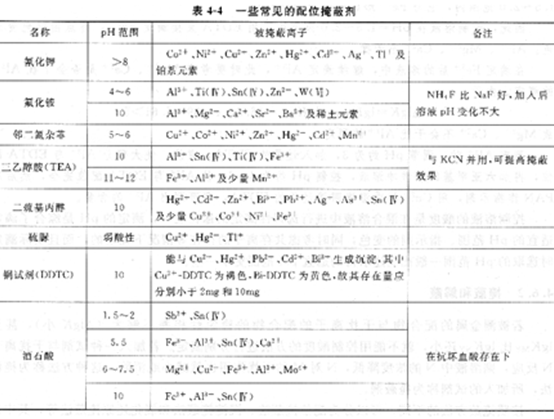
常見的配位掩蔽劑見表。
參考資料:分析化學







