混合離子的分別滴定(二)
發布時間:2017-09-01
使用掩蔽劑時需注意以下幾點:
①掩蔽劑應不與待測離子配位,即使能生成配合物,其穩定性也應遠小于待測離子與EDTA配合物的穩定性。
②掩蔽劑與干擾離子形成的配合物不僅應遠比與EDTA形成的配合物穩定,而且形成的配合物應為無色或淺色,不影響終點的判斷。
③使用掩蔽劑時應注意適用的pH范圍。例如在Ph=8~10時測定Zn2+,用鉻黑T作指示劑,則用NH4 F可掩蔽Al3+。但是在測定.Mg2+、Ca2+和A13+溶液中的Mg2+、Ca2+總量時,在Ph=10滴定,因為F-與被測物將會生成CaF2沉淀,故不能用氟化物來掩蔽Al3+。
④使用掩蔽劑時還要注意其性質和加入時的pH條件是否合適。例如,KCN是劇毒物,只允許在堿性溶液中使用;掩蔽Fe3+、Al3+等的三乙醇胺,必須在酸性溶液中加人,然后再堿化,否則Fe3+將會生成氫氧化鐵沉淀而不能進行配位掩蔽。
4、沉淀掩蔽法
在體系中加入一種沉淀劑,使其中的干擾離子濃度降低,在不分離沉淀的情況下直接進行滴定,這種方法稱為沉淀掩蔽法。例如,測定Mg2+、Ca2+含量時,由于IgKcaY=10.7,1gKMgY=8.7,△lgK<5,不能用控制酸度的方法分別滴定。但它們的氫氧化物溶解度相差較常用的沉淀掩蔽劑見表4-5。
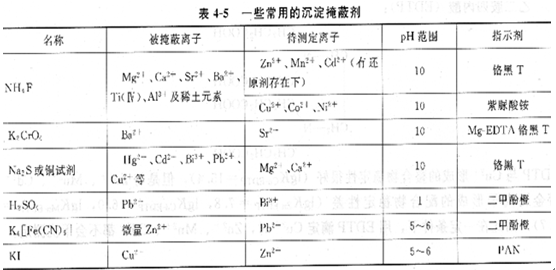
由于一些沉淀反應進行的不夠完全,特別是過飽和現象使沉淀不易析出;發生沉淀反應時,通常伴隨共沉淀現象;沉淀會吸附金屬離子指示劑,從而影響終點觀察;一些沉淀顏色深、體積龐大而妨礙終點的判斷。因此在實際工作中,沉淀掩蔽法用得不多。
5、氧化還原掩蔽法
利用氧化還原反應,使干擾離子的氧化值發生改變而消除其干擾,這種方法稱為氧化還原掩蔽法。例如,測定鋯鐵中的鋯,由于鋯和鐵的EDTA配合物的穩定性相差不大(△1gK=lgKzrY2-―lgKFeY一=29.9―25.1=4.8<5),Fe3+會干擾鋯的滴定。若加入抗壞血酸或鹽酸羥胺將Fe3+還原為Fe2+,由于Fe2+-EDTA配合物的穩定常數(1gKfeY2-=14.33)比Fe3+-EDTA配合物的穩定常數小得多,因此,Fe2+不干擾鋯的測定。
常用的還原劑有抗壞血酸、鹽酸羥胺、硫脲、聯氨等,其中有些還原劑同時又是配位劑。例如,Na2 S2 03可將Cu2+還原為Cu+,并與cu+配位。
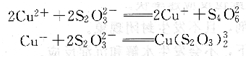
有些高氧化值狀態的干擾離子與EDTA不發生配位反應,可以通過將低氧化值狀態的干擾離子氧化成高氧化值的方法來消除干擾。例如Cr3+對配位滴定有干擾,但CrO2-4、Cr2 O2-7;則對滴定沒有干擾。
6、選擇其他配位劑滴定
除了EDTA外,其他氨羧類配位劑與金屬離子形成配合物的穩定性也各有特點,可以選擇不同配位劑進行滴定,以提高金屬離子滴定的選擇性。
乙二胺四丙酸(EDTP):
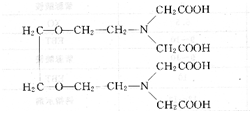
EDTP與Cu2+形成的螯合物穩定性很好(1gKcu-EDTP=15.4),但是與Zn2+、Mn2+、Cd2+等金屬離子形成的配合物穩定性差(1gKcu-EDTP= 7.8,1gKcu-EDTP=6.0,1gKcu-EDTP =4.7),因此在一定條件下,用EDTP滴定Cu2+時,Zn2+、Mn2+、Cd2+都不會干擾測定。
參考資料:分析化學







