配位滴定法――金屬指示劑(一)
發布時間:2017-09-01
一、金屬指示劑的作用原理
金屬指示劑是一種有機配位劑,它能與金屬離子配合生成比較穩定的化合物,配位滴定中,利用金屬指示劑在游離態和化合態的顏色不同來指示滴定等量點,用In表示金屬指示劑(略去電荷)。
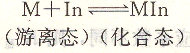
等量點前,由于指示劑的加入,溶液呈MIn顏色;達等量點時,EDTA置換出指示劑而使其呈現游離態的顏色,因而發生了顏色的改變。例如,用鉻黑T指示EDTA滴定Mg2+過程,滴定時,鉻黑T先與Mg2+配合。當接近等量點時,由于EDTA與Mg2+生成的配位化合物較鉻黑T與Mg2+形成的配位化合物更穩定,故EDTA能夠從指示劑與金屬離子配位化合物中奪取出金屬離子,使指示劑游離出來,溶液呈鉻黑T游離態色(藍色),即指示劑滴定到達終點。

能與金屬離子生成有色化合物,并能通過顏色改變而指示溶液中金屬離子濃度變化的有機配位劑稱為金屬指示劑。
作為配位滴定的金屬指示劑必須具備下列條件:
(1)在滴定條件下,游離態指示劑顏色和它與金屬離子化合態的顏色顯著不同,使滴定終點變色明顯。
(2)指示劑與金屬離子形成的配位化合物應有適當的穩定性。一方面金屬離子和指示劑形成配位化合物的穩定性必須小于金屬離子和EDTA所形成的配位化合物的穩定性,這樣在等量點時,EDTA才能置換出指示劑來,從而顯示出顏色變化。另一方面金屬離子和指示劑形成的配位化合物應足夠穩定,否則,在滴定等量點前指示劑就開始游離出來而使溶液變色不敏銳。一般來說,要求lgK’(MIn)>4,lgK’(MY)一lgK’(MIn)≥2。
(3)指示劑和金屬離子配合反應迅速,變色可逆性強,生成配合物易溶于水,穩定性好。
二、指示劑的封閉、僵化現象
指示劑和金屬離子所形成的配位化合物穩定性比EDTA和金屬離子所形成配位化合物更穩定,即lgK’(MIn)>lgK’(MY),以致到等量點時,EDTA就不能將指示劑置換出來,即使加入過量的EDTA溶液,也不會有顏色改變,這種現象稱為指示劑的封閉。如鉻黑T能被Fe2+,Al3+,Ni3+,Cu2+,Co2+等離子封閉,如溶液中有此種離子存在,就不能用鉻黑T作指示劑。
為了消除封閉現象,必須除去對指示劑有封閉作用的離子或采用掩蔽的方法,加入配合能力比鉻黑T更強的配位劑,將這些干擾離子掩蔽起來,才能進行滴定。
有些指示劑和金屬離子所形成的配位化合物的穩定性與EDTA和金屬離子所形成的配位化合物的穩定性相差不大,因而EDTA和MIn之間的置換反應緩慢,拖延終點的到達,或因MIn化合物溶解度很小,致使等量點時顏色變化不夠明顯,這種現象叫做指示劑的僵化。可以加熱或加入適當的有機溶劑以增大其溶解度和提高置換速度,使指示劑變色明顯。例如,用PAN指示劑時溫度較低易發生僵化,可加入酒精或加熱,接近終點時,緩慢滴定并劇烈振搖,使置換反應加速消除僵化現象。
金屬指示劑多數是具有若干雙鍵的有色有機化合物,容易被日光、氧化劑、空氣等分解,有些在水溶液中不穩定。因此,在使用時,可與中性鹽(如NaCl)配成固體指示劑使用,防止變質,最好是用時新配。
應該指出,金屬指示劑本身還是一種多元弱酸或弱堿,隨著溶液pH不同,其存在形式有所不同,從而顯出不同的顏色。
鉻黑T是一個三元酸,在溶液中存在三級離解平衡。
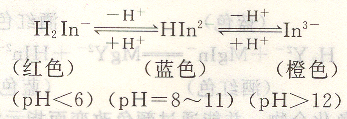
鉻黑T與許多陽離子,如Ca2+,Mg2+,Zn2+等形成紅色配位化合物。可見只有Ph=8~11進行滴定,終點才由金屬離子與鉻黑T的紅色配位化合物變成游離的指示劑的藍色。否則,在pH<6或pH>12時,指示劑游離色為紅色或橙色,等量點時,顏色變化不明顯。因此,使用金屬指示劑時,必須注意選用合適的pH范圍。
三、常用的金屬指示劑
1、鉻黑T
鉻黑T是褐色粉末,帶有金屬光澤,溶于水,是一種偶氮染料,化學名稱為1-(1一羥基一2一萘偶氮基)一6一硝基一2一萘酚一4-磺酸鈉,結構式為:
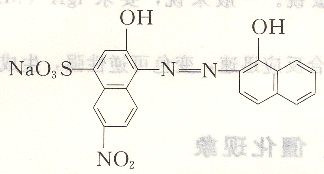
其最適用于pH=9~10,一般在pH=10的緩沖溶液中,用EDTA能直接滴定Mg2+,Zn2+,Ca2+,Pb2+和Hg2+等離子。但它對Ca2+不靈敏,一般在有Mg―EDTA時測Ca2+終點才明顯。測Ca2+、Mg2+總量時,采用鉻黑T較好。鉻黑T在水溶液中不穩定,很容易因聚合而變質,可加入三乙醇胺防止聚合。鉻黑T在空氣中易被氧化,可加入少量鹽酸羥胺防止氧化。為防止變質,有時也采用鉻黑T與干燥的純氯化鈉混合,配成固體混合物使用(按1+100混合)。滴定時,一般將約O.1g指示劑直接加入溶液中。
參考資料:分析化學







