配位滴定法――金屬指示劑(二)
發布時間:2017-09-01
2、鈣指示劑(NN)
鈣指示劑為紫黑色粉末,化學名稱為2一羥基一1一(2一羥基一4一磺酸基一1一萘偶氮)一3一萘甲酸,其結構式為:
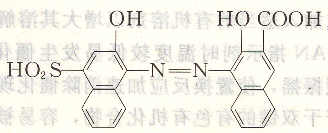
鈣指示劑是二元弱酸,在不同pH時,其顏色不同,在水中平衡如下:
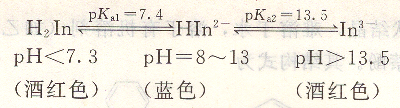
鈣指示劑在pH=12~14時與Ca2+作用呈紅色化合物,因此可用于Ca。2+與Mg2+共有時測定Ca2+(終點顏色是由紅色變為藍色)。先調節pH=12使Mg(OH)2沉淀后,再加人鈣指示劑,這樣可以減少沉淀對指示劑的吸附,在有少量Mg2+時,終點顏色變化非常敏銳。
Fe3+,A13+,Ti4+,Cu2+,Co2+,Ni2+,Mn2+等離子對鈣指示劑有封閉作用。Ti4+,Al3+和少量Fe3+可用三乙醇胺掩蔽。Cu2+,Ni2+,Co2+等離子可用KCN掩蔽。
鈣指示劑在水和酒精溶液中均不穩定,常用干燥的NaCl,KNO3或K2SO4, 以(1+100)或(1+200)配成固體指示劑,但混合后的指示劑也會逐漸氧化,最好是在使用時新配。
3.二甲酚橙(XO)
二甲酚橙是紫色結晶,易溶于水,化學名稱為3,3'-雙[N,N'(二羥甲基)氨甲基]-鄰甲酚磺酞。其結構式為:
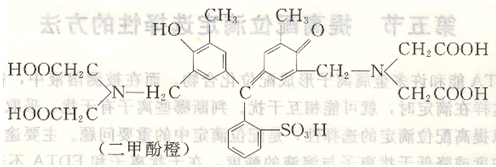
二甲酚橙在水溶液中,有如下平衡:
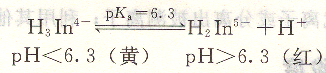
二甲酚橙和金屬離子所形成的配合物都是紅紫色,因此只能在pH<6.3的酸性溶液中使用,終點由紅紫色變為亮黃色。
很多金屬離子可用二甲酚橙作指示劑直接滴定,如Zr4+(pH<1),Bi3+(Ph=1~2),Th4+(pH=2.5~3.5),Sc3+(pH=3~5),Pb2+,Zn2+,Cd2+,Hg2+,Ti2+等離子和稀土元素的離子(pH=5~6)都可以直接滴定。Fe3+,A13+,Ni2+和Cu2+等離子也可以加入過量EDTA后用Zn2+溶液回滴。
Fe3+,Al3+,Ni2+和Ti4+一等離子對二甲酚橙有封閉作用。Fe3+和Ti4+可用抗壞血酸還原,Al3+可用氟化物掩蔽,Ni2+可用鄰菲噦啉掩蔽,乙酰丙酮可掩蔽Th4+和Al3+。
二甲酚橙一般配成O.5%的水溶液,可保存2~3周。
4.PAN
PAN是橙紅色針狀結晶,難溶于水,溶于有機溶劑(如乙醇中),化學名稱1-(2-吡啶偶氮)-2-萘酚。其結構式為:
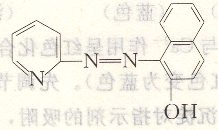
PAN在溶液中存在下述平衡:
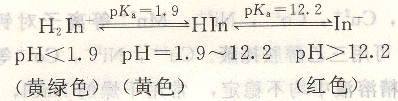
PAN可與金屬離子Cu2+,Bi3+,Cd2+,Hg2+,Pb2+,Zn2+,Sn2+,In3+,Fe2+,Mn2+,Ni2+,Re3+,Th4+等形成紅色螯合物。PAN可以在pH=1.9~12.2范圍內使用,終點由紅色變為黃色。由于這些配合物溶解度很小,滴定時,易形成膠體溶液或沉淀致使變色緩慢,可采用加熱或加入乙醇來加速變色。
PAN常配成0.1%的乙醇溶液使用。
參考資料:分析化學







