首頁>技術中心>技術資訊>EDTA與金屬離子的配位化合物(一)
EDTA與金屬離子的配位化合物(一)
發布時間:2017-09-01
一、EDTA與金屬離子配合物的特點
1、穩定性強
EDTA和金屬離子所形成的配位化合物結構中有5個5原子環,因此配位化合物非常穩定,如,Co2+和EDTA的配位化合物,其結構示意圖如圖6―1所示。
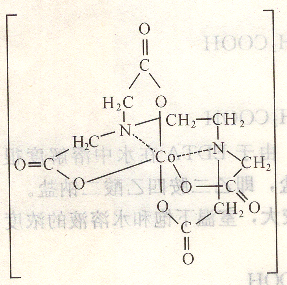
2、配位比簡單
EDTA分子中,具有6個可與金屬離子形成配位鍵![]() 同時,還有4個可電離的H+,一般1~4價的金屬離子的配位數大多為4或6,當EDTA與金屬離子配位時,一個EDTA分子就能滿足一個金屬離子的配位數和電荷的要求。所以,當EDTA與1~4價的金屬離子配位化合時,其配位化合比大多為1∶1,生成的配位化合物可用下列反應表示。
同時,還有4個可電離的H+,一般1~4價的金屬離子的配位數大多為4或6,當EDTA與金屬離子配位時,一個EDTA分子就能滿足一個金屬離子的配位數和電荷的要求。所以,當EDTA與1~4價的金屬離子配位化合時,其配位化合比大多為1∶1,生成的配位化合物可用下列反應表示。
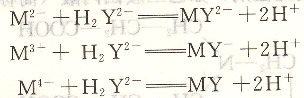
這樣在計算中,EDTA與1~4價的金屬離子配合時均取其化學式作為基本單元,計算簡便。
3、有利于用指示劑確定終點
大多數金屬離子與EDTA生成的是無色配位化合物,因此,有利于選擇適當指示劑來確定終點。但有色離子與EDTA配位一般生成顏色更深的配位化合物,如:
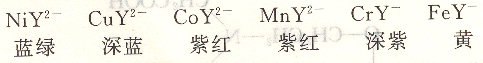
因此,在滴定這些離子時,應盡量使其濃度低些,以免在確定終點時,影響觀察。
二、金屬離子與EDTA的配位平衡
EDTA與金屬離子形成 1:1的配位化合物,在溶液中的離解平衡,可用下式表示(為討論方便,略去式中的電荷)。

式中:[MY]――M―EDTA配位化合物的濃度,mol/L;
[M]――未配位的金屬離子的濃度,mol/L;
[Y]――未配位的EDTA陰離子的濃度,mol/L。
K穩的數值一般較大,為了方便起見,采用lgK穩來表示,如反應:
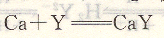
在平衡時,CaY的穩定常數為K穩=4.9×1010,而lgK穩=1g4.9×1010=lO.69。
常見金屬離子和EDTA的配位化合物的穩定常數對數值見表6―1所示。
配位化合物的穩定性,主要決定于金屬離子和配位劑的性質。同一配位劑與不同離子形成的配位化合物,根據其穩定常數的大小,可以比較其穩定性。K穩越大,配位化合物越穩定,如CaY2-的lgK穩=10.69,而MgY2-的lgK穩=8.69,則CaY2-較MgY2-穩定。
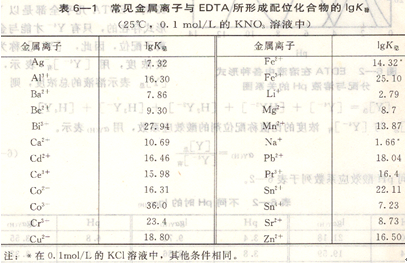
兩種同類型配位化合物,由于穩定性不同,決定了形成配位化合物時的先后次序。如在Fe3+,Ca2+中滴加EDTA時,因lgK穩(FeY)=25.1,lgK穩,(CaY)=10.69,加入的EDTA首先與Fe3+配位化合,后才與Ca2+配位化合。在實際分析中,如果Fe3+存在,測定Ca2+時Fe3+將產生干擾。
當某一金屬離子與兩種不同的配位劑形成配位化合物時,穩定性強的配位劑可以將穩定性弱的配位化合物中的配位劑置換出來,以生成更為穩定的配位化合物。如,用EDTA測定Zn2+,在用鉻黑T作指示劑時,需加入氨一氯化銨緩沖溶液,此時有[Zn(NH3)4]2+(1gK穩=8.7)的配位化合物生成。當滴定時,由于EDTA對Zn的配位化合物更為穩定(1gK穩(ZnY)=16.50),故EDTA可以從[Zn(NH3)4]2+中把NH3置換出來。
三、只考慮酸效應時EDTA金屬配合物的穩定性
1、EDTA的離解平衡及條件穩定常數
EDTA是一種四元酸,一般用H4Y表示。在水溶液中,具有四級離解平衡關系:
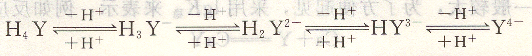
和其他多元酸相似,EDTA在水溶液中共有五種存在形式,即H4Y, H 3 Y一, H 2 Y2-, HY3-,Y4-。在一定的酸度下,各種形式的濃度有一定比例,其分布與溶液pH的關系如圖6―2所示。
參考資料:分析化學







