首頁>技術中心>技術資訊>EDTA與金屬離子的配位化合物(二)
EDTA與金屬離子的配位化合物(二)
發布時間:2017-09-01
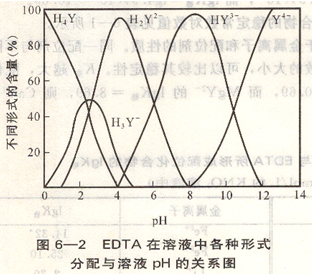
從圖6―2可以看出,當pH>12時,EDTA幾乎全部是以Y4-形式存在的,只有Y4-才能與金屬離子配位,因此, [Y4-]稱為有效濃度,用[Y4-]有表示,而[Y]總表示溶液的總濃度,則:
![]()
[Y]總與[Y4-]有濃度的比值稱配位劑的酸效應系數,用ay(H),表示。
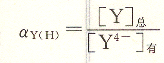
不同pH酸效應系數列于表6―2。
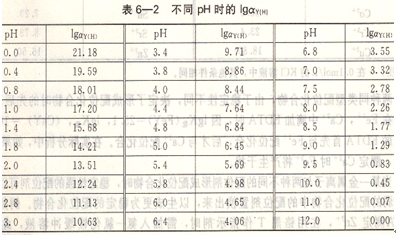
從表中看出ay(H)與溶液酸度有關,隨著溶液pH增大而減小,當pH<12時,![]()

當pH>12時,EDTA的有效濃度[Y4-]幾乎等于EDTA的總濃度[Y]總。
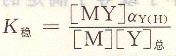
將上式取對數得:
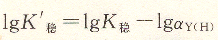
K’穩叫做表觀穩定常數(即條件穩定常數),它的大小說明在pH不同時配位化合物的實際穩定程度。
由計算得pH=10時,MgY和PbY都較穩定;而pH=6時,MgY不穩定,PbY仍較穩定。上述說明酸度增大,酸效應系數也增大,配位化合物的表觀穩定常數下降。在較大的酸度條件下,[Y4-]有降低,配位化合物的配合能力下降,即對任一配位化合物,酸度越低,配合能力越強,反之則配合能力越弱。不同金屬離子和EDTA的配位化合物的穩定性是不同的,配合能力強的可在較高的酸度下配合,配合能力弱的,只能在較低的酸度下配合。這樣,可用表觀穩定常數來表明EDTA在酸度影響下的實際配合能力,即在一定條件下的實際配合能力。
這里只討論了酸度對EDTA與金屬離子配合穩定性的影響,它是主要的一方面。此外,在滴定分析中,還有金屬離子的水解、金屬離子與EDTA形成的酸式或堿式的配位化合物以及其他配位化合物所引起的混合物的影響等。
2、酸效應曲線和單一離子滴定可行性判斷與pH的選擇
表觀穩定常數可以表明配位化合反應在具體條件下的完全程度。
如果被測離子的初濃度為[M0],終點時未配合的金屬離子濃度為[M],滴定的允許誤差為T(一般為0.1%)。則在滴定終點時必須符合下列要求。
(1)被測離子幾乎全部被EDTA配合,即[MY]=[M0];
(2)被測離子剩余的濃度應小于或等于滴定的允許誤差和起始濃度的乘積,即[M]≤T[M0];
(3)過量EDTA的濃度也應小于或等于滴定允許誤差和起始濃度乘積,即[Y4-]≤丁[M0]。
將這三個式子代入式(6―6),即得:
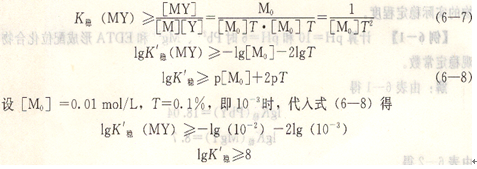
在上述設定條件下,金屬離子和EDTA所形成配位化合物的表觀穩定常數必須大于或等于8時,配位滴定才能進行。如果滴定條件不同,即T和[M0]變動,則必須用式(6―8)進行計算求得相應的lgK’穩,才能判別配位滴定反應能否符合要求。
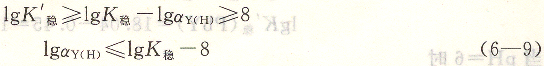
利用式(6―9)可以估算金屬離子在上述條件下,用EDTA滴定所允許的最小pH。
參考資料:分析化學







