首頁>技術(shù)中心>技術(shù)資訊>EDTA與金屬離子的配位化合物(三)
EDTA與金屬離子的配位化合物(三)
發(fā)布時間:2017-09-01
四、考慮其他副反應(yīng)時的副反應(yīng)系數(shù)
配位化合物滴定中涉及的化學(xué)平衡比較復(fù)雜,不能像酸堿反應(yīng)那樣,單靠引入分布系數(shù)、分布系數(shù)圖來解決所涉及的平衡組分計(jì)算。以EDTA配位化合物滴定為例:
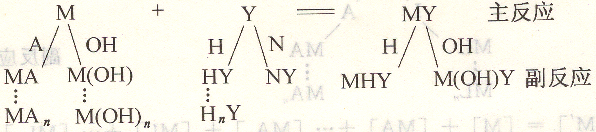
除M與Y之間生成MY的主反應(yīng)外,將受介質(zhì)pH、其他共存金屬離子(N)以及配合劑(A)的影響發(fā)生其他反應(yīng),這類反應(yīng)統(tǒng)稱為副反應(yīng)。它將影響主反應(yīng)進(jìn)行的程度,影響主反應(yīng)組成及生成物的濃度。用副反應(yīng)系數(shù)定量描述副反應(yīng)對主反應(yīng)的影響程度。
1、滴定劑Y的副反應(yīng)及副反應(yīng)系數(shù)αy
(1)EDTA酸效應(yīng)與酸效應(yīng)系數(shù)ay(H)
(2)共存離子效應(yīng)
除金屬離子M與Y生成配位化合物反應(yīng)外,共存金屬離子N也與Y生成配合物,反應(yīng)稱為共存離子效應(yīng),是滴定劑Y存在的副反應(yīng),用副反應(yīng)系數(shù)ay(H)表示。
(3)滴定劑Y的總副反應(yīng)系數(shù)aY表示。
aY= ay(H)+ ay(n)―1
滴定劑副反應(yīng)系數(shù)雖然有幾項(xiàng),我們討論的滴定中僅考慮ay(H)一項(xiàng)。
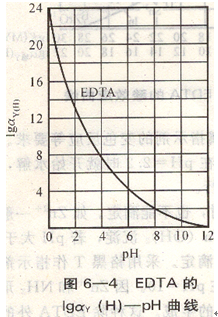
對于酸效應(yīng)系數(shù)我們僅做理論上的了解,搞清是怎樣計(jì)算出來的即可,在實(shí)際應(yīng)用中可查表得到。由lgay(H)-pH表6-2,了解lga ay(H)隨pH變化的趨勢,滴定介質(zhì)pH越低,酸度愈高,酸效應(yīng)系數(shù)愈大,影響愈大。
2、金屬離子的副反應(yīng)及副反應(yīng)系數(shù)
由于其他配合劑(L或A)存在,使金屬離子(M)參加主反應(yīng)的能力降低的現(xiàn)象稱為金屬離子的副反應(yīng),其副反應(yīng)系數(shù)用a(M(L))表示。
a(M(L))表示金屬離子總濃度[M,]是游離金屬離子濃度[M]的多少倍。
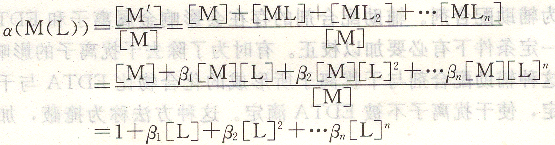
可見,a(M(L))僅是[L]的函數(shù)。
溶液中金屬離子因介質(zhì)pH可形成羥基配合物,溶液中存在的輔助配合劑、掩蔽劑,緩沖溶液組分都可能與金屬離子生成配位化合物,發(fā)生多種副反應(yīng)。此時應(yīng)當(dāng)用金屬離子總副反應(yīng)系數(shù)a(M)表示。若溶液中有兩種配合劑L和A同時與金屬離子M發(fā)生副反應(yīng)。
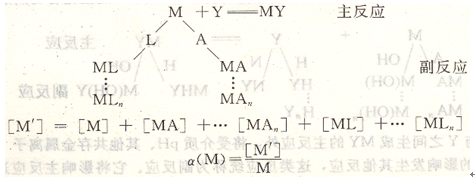
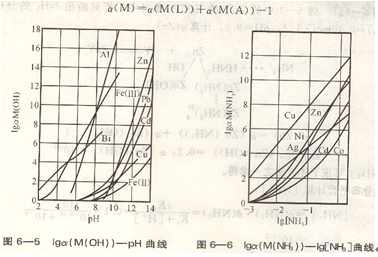
對初學(xué)者來說,無需對n種配合劑發(fā)生的多個副反應(yīng)進(jìn)行重復(fù)計(jì)算,只需從兩種副反應(yīng)即a(M)=a(M(L))+a(M(A))-1人手,掌握用副反應(yīng)系數(shù)方法處理復(fù)雜的配位化合物平衡即可。
在水溶液中,當(dāng)溶液酸度較低時,金屬離子生成多種羥基或多核羥基配位化合物,以a(M(0H))表示(見圖6―5)。在配位化合物平衡計(jì)算中,溶液酸度是必需考慮的因素,a(M(OH))可由附錄中附表5查得。
3、配位化合物MY的副反應(yīng)及副反應(yīng)系數(shù)
配位化合物MY在酸度較高時,能生成MHY,使EDTA對M的總配合能力增強(qiáng);配位化合物MY在酸度較低時能生成MOHY的副反應(yīng),同樣增加EDTA對M的配合能力,這種副反應(yīng)分別以副反應(yīng)系數(shù)a(MY(H))、a(MY(OH))表示
MY+H=MHY
MY+OH=MOHY
由于MHY及MOHY大多不太穩(wěn)定,一般忽略不計(jì)。
參考資料:分析化學(xué)







