土壤PH值的測定
發布時間:2017-09-01
一、分析意義
土壤酸堿度是土壤重要的基本性質之一,是土壤形成過程和熟化培肥過程的一個指標。土壤酸堿度對土壤中養分存在的形態和有效性,對土壤的理化性質、徽生物活動以及植物生長發育都有很大的影響。
由于大多數作物必需的營養元素的有效性與土壤的pH值有關,在我們掌握足夠的土壤科學知識后,是可以根據土壤的pH值相當可靠地評估土壤中養分的有效狀況。所以土壤pH值又是估計植物營養元素相對有效性的指標。總的來看,土壤對植物生長所必需的大多數營養元素,于pH6-7范圍內有效度最高。例如:土壤中磷酸鹽,在pH值小于6.5時,因磷酸鐵、磷酸鋁的出現而降低其有效性,當pH值大于7.0時,則因形成磷酸鈣,植物難以利用。相對而言,土壤pH6.5~7.0時,土壤對磷的固定最少,其對植物的有效性最大。
一般地講,土壤中的細菌(硝化細菌、固氮菌和纖維分解細菌等)和放線菌,適宜于中性和微堿性環境,在此條件下,其活動旺盛,有機質分解快,固氮作用強,因而土壤有效氮供應較好;而在pH值<5.5強酸性土壤中,其活性急劇下降,此時真菌活動占優勢,土壤有效氮供應不足,還可能有NO2一積累。此外,在酸性過強的情況下,植物會因鋁、錳的出現而遭毒害;而在強堿性土壤中,由于膠體上交換性鈉多,使土粒高度分散,物理性質惡化等等。
我國各類土壤中所含的鹽基種類和數量,決定于它們的酸堿性,而各類土壤的酸堿性同特定的生物氣候條件、地形、母質來源以及成土過程的長短等均有密切的關系。我國地域遼闊,由南向北pH值逐漸升高。大致以北緯330為界,在其以南地區,因氣候溫暖濕潤,礦物風化和雨水淋溶作用強烈,除部分受母質影響的土壤和石灰性沖積土外,大部分土壤為鹽基不飽和,而且緯度愈低,鹽基飽和度愈小,如廣東、廣西、云南和貴州等省紅壤和黃壤,鹽基飽和度一般在20寫-30%,有的甚致小于10%,故地帶性土壤呈酸性至強酸性。土壤pH一般在5.0~6.5,低的可小于5.0,如臺灣省的新八仙山,海南省的五指山的黃壤pH可低至3.6~3.8。在北緯330以北地區,除東部原始森林植被下發育的土壤的鹽基飽和度約60%~80%外,大部分土壤為鹽基飽和,而且有一定數量的碳酸鈣.如華北、內蒙和西北地區,由于降雨量少而燕發強烈,土壤中的鹽分不僅得不到淋洗.反而從下層和地下水中向表土集聚,土壤pH一般在7.5~8.5,高的達10.5。由此可見,我國土壤酸堿度南北差異很大,由南方強酸性土壤到北方的強堿性土壤,按氫離子濃度計算,相差達七個數量級(中國科學院南京土壤研究所,1978)。
二、方法選擇的依據
土壤pH值是土壤溶液中氫離子活度的負對數。它是土壤中最重要的一種物理化學性質,可用水處理土壤制成懸濁液進行測定。許多西歐和前蘇聯學者建議測定土壤在中性鹽溶液中的pH,其中最常用的是氯化鉀溶液[c(KCI)=1.0 mol? L-1],我國也有許多實驗室用以測定強酸性(pH值<5.5)的土壤。近年來,西歐有些國家測定土壤在抓化鈣溶液[c(CaC12)=0.01mol?L-1]中的PH。但土壤在氛化鉀溶液或抓化鈣溶液中的pH值較在水中者為低,因此,測定結果應注明,當解釋結果時,要考慮這種差異。
在測定土壤pH時,選擇一個合適的水土比例是非常重要的。水土比例愈大,PH升愈高。國際土壤學會規定水土比為2.5∶1,在我國例行分析中以1∶1,2.5∶1, 5∶1較多,為使測定結果更接近田間的實際情況,水土比以I∶1或2.5∶1甚至飽和泥漿較好,鹽土用5∶1。此外,隨著堅固的玻瑞電極的出現,對于一般水分含量的田間土壤也有可能進行原位的測定。
土壤pH值的測定可分為電位法和比色法兩大類,隨著分析儀器的進展,比色法現在僅在田間約測時使用,目前,我國各個土壤分析實驗室一般都采用電位法。電位法有準確((0.02pH)、快速、方便等優點。比色法不需要貴重儀器,受測量條件限制較少,便于野外測定,但準確度低((0.5pH),對于要求0.5pH單位準確度的測盆仍是方便可靠的。
二、電位法
1、 方法原理
用pH計測定土壤懸濁液pH時,常用玻璃電極為指示電極,甘汞電極為參比電極。當pH玻璃電極和甘汞電極插入土壤懸濁液時,構成一電池反應,兩者之間產生一個電位差,由于參比電極的電位是固定的,因而該電位差的大小決定于試液中的氮離子活度,氫離子活度的負對數即為pH,可在pH計上直接讀出pH值。
2、儀器及設備
pH計(注1);玻瑞電極(注2);飽和甘汞電極(注3);或復合電極。
3、試劑
(1) pH4.01標準緩沖溶液;10. 21 g在105℃供過的苯二甲酸氫鉀(KHC8H8O8,分析純),用水溶解后定容至1L。
(2)pH6.87標準緩沖溶液:3.39g在50℃烘過苯二甲酸氫鉀(KHC2HO4,分析純) 和3.53g無水磷酸氫二鈉(Na2HPO4,分析純) ,溶于水后定容至1L。
(3) pH9.18標準緩沖溶液:3.80 g硼砂(Na2B4O7?10H20,分析純)溶于無二氧化碳的冷水中,定容至1L。此溶液的pH易于變化,應注意保存。
(4)氯化鈣溶液〔c(CaCI2?2H20) = 0.01 mol?L-1]:147.02g氯化鈣(CaC12?2H2O,化學純)溶于200 ml,水中,定容至1L,吸取10mL于500ml,燒杯中,加400ml,水,用少量氫氧化鈣或鹽酸調節pH為6左右,然后定容至1L。
4、操作步驟
(1)待側液的制備:稱取通過2mm篩孔的風干土樣10.00g于50mL,高型燒杯中,加入25mL無二氧化碳的水(注4)或氛化鈣溶液〔試劑(4),中性、石灰性或堿性土測定用]。用玻璃棒劇烈攪動1 min~2min,靜置30 min,此時應避免空氣中氨或揮發性酸氣體等的影響,然后用pH計測定(注5)
(2)儀器校正:把電極插人與土壤浸提液pH接近的緩沖溶液中,使標準溶液的pH值與儀器標度上的pH值相一致.然后移出電極,用水沖洗、濾紙吸干后插人另一標準緩沖溶液中,檢查儀器的讀數。最后移出電極、用水沖洗、濾紙吸干后待用。
(3)側定:把玻璃電極的球泡浸入待測土樣的下部懸濁液中,并輕微搖動,然后將飽和甘汞電極插在上部清液中,待讀數穩定后,記錄待測液pH值。每個樣品測完后,立即用水沖洗電極,并用干濾紙將水吸干再側定下一個樣品,在較為精確的測定中,每測定5個~6個樣品后,需要將飽和甘汞電極的頂端在飽和抓化鉀溶液中浸泡一下,以保持頂端部分為抓化鉀溶液所飽和,然后用pH標準緩沖溶液重新校正儀器。
5、結果計算
一般的pH計可直接讀出pH值,不需要換算。
6、允許偏差
兩次稱樣平行測定結果的允許差為0.1pH;室內嚴格掌握測定條件和方法時,精密pH計的允許差可降至0.02 pH。
7、注意事項
(1)pH計的使用參照儀器說明書。
(2)使用玻璃電極注意事項:①干放的電極使用前應在鹽酸溶液〔c(HCI)=0.1 mol?L-1〕或水中浸泡12小時以上,使之活化。②使用時應先輕輕震動電極,使其內溶液流人球泡部分,防止氣泡的存在。③電極球泡極易破損,使用時必須仔細謹慎,最好加用套管保護。
④電極不用時可保存在水中,如長期不用可放在紙盒內干放。
⑤玻璃電極表面不能沾有油污,忌用濃硫酸或鉻酸洗液清洗玻璃電極表面。不能在強喊及含氛化物介質中或粘土等膠體系中停放過久。以免損壞電極或引起電極反應遲純。
(3)使用飽和甘汞電極注意事項:①電極應隨時由電極測口補充飽和氯化鉀的內溶液和氯化化鉀固體。不用時可以存放在飽和抓化鉀溶液中或前端用橡皮套套緊干放。②使用時要將電極測口的小橡皮塞拔下,讓氯化鉀溶液維持一定的流速。③不要長時間浸在被側溶液中,以防止流出的氛化鉀污染待測液。④不要直接接觸能侵蝕汞和甘汞的溶液,如濃度大的S2-溶液。此時應改用雙液接的鹽橋,在外套管內灌注抓化鉀溶液。也可用瓊脂鹽橋。瓊脂鹽橋的制備:稱取優等瓊脂3g和氯化鉀(KCI,分析純)10g,放于150 mL上加熱溶解,再用滴管將溶化了的瓊脂溶液灌注于直徑4mmU形管中,加加水100 mL,在水浴上加熱溶解,再用滴管將溶化了的瓊脂溶液灌注于直徑4mm的U形管中,中間要沒有氣泡,兩端要灌滿,然后浸在氯化鉀溶液 [c(KCI)=1.0 mol?L-1]中。
(4)如果要側定酸性土壤(包括潛性酸)的pH值,可用氛化鉀溶液[c(KCI)=1.0 mol?L-1〕代替無二氧化碳蒸餾水,其它操作步驟均與水浸提液相同。
(5)測定時注意事項:①土壤不要磨得過細,以通過2mm孔徑篩為宜。樣品不立即測定時,最好貯存于有磨口的標本瓶中,以免受大氣中氨和其他揮發氣體的影響。②加水氯化鈣后的平衡時間對測得的土壤pH值是有影響的,且隨土壤類型而異。平衡快者,1min即達平衡;慢者可長至lh。一般來說,平衡30min是合適的。③ PH玻璃電極插人土壤懸液后應輕微搖動,以除去玻璃表面的水膜,加速平衡,這對緩沖性弱和pH較高的土壤尤為重要。④飽和甘汞電極最好插在上部清液中,以減少由于土壤懸液影響液接電位而造成的誤差。
三、比色法
1、 方法原理
指示劑隨溶液的pH值而改變顏色。因此,根據混合指示劑與pH4.0~8.0的標準緩沖溶液系列產生的顏色,用各種有色的無機試劑溶液,按不同比例混合成模擬的pH永久色階的貯存液,標明其pH值(每個間隔為0.2 PH單位),然后在待側液中加人用本法配側的混合指示劑,經顯色后與其進行目視比色,即可迅速地確定出待側液的pH值。
2、試劑
(1)pH混合指示劑:0.1 g甲基紅盆于瑪瑙研缽中,加人少量無水乙醉研磨,配成100 ML乙醉溶液,加7.4 mL氫氧化鈉溶液[c(NaOH)=0.050 mol?L-1〕,用水稀釋到500ML,另稱取0.lg溴百里酚蘭,溶于52 mL無水乙醉中,加3.2 mL氫氧化鈉溶液[c(NaOH)=0.050Mol? L-1],用水稀釋到250mL。將1份甲墓紅溶液和2份澳百里酚蘭溶液混合,即為pH混合指示劑。此溶液存放在深色的滴瓶中。
(2)抓化枯溶液:59.5 g氯化鈷(CoCI2?6H2O,分析純)溶于1L鹽酸溶液[ψ(HCI)=1%]中。
(3)氯化鐵溶液:45.05 g抓化鐵(FeC13?6H2O,分析純)溶于1 L鹽膠溶液〔ψHCI)=1%]中。
(4)氯化銅溶液:400g氛化鋼(CuCI2?2H2O,分析純)溶于1L鹽酸溶液[ψHCI)=1%]中。
(5)硫酸銅溶液:200 g硫酸鑰(CuSO4?5H20,分析純)溶于1L硫酸溶液〔ψH2SO4)=1%]中。
將上述配好的2至5溶液按表2-1中的比例混合,并加人一定量的水配制成永久色階。各級溶液分別貯存于平底試管(規格要一致)中,標明pH值,加塞,蠟封保存。
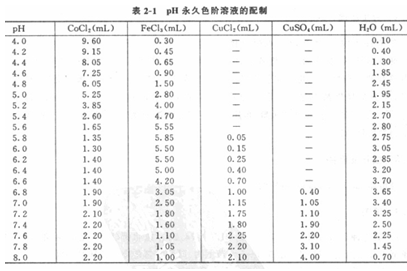
3、操作步驟
取10mL水浸出液(水:土為2.5:1)置于平底試管中(與標準色階試管同樣規格),加人12滴pH棍合指標荊,搖勻后馬上與永久色階進行目視比色,確定其pH值。
4、允許偏差
兩次平行測定結果允許偏差為0.5PH。
參考資料:土壤農業化學分析方法







