首頁>技術(shù)中心>技術(shù)資訊>土壤可溶鹽分析(二)
土壤可溶鹽分析(二)
發(fā)布時間:2017-09-01
(2)儀器
電導(dǎo)儀一臺。鉑電極和鍍鉑黑電導(dǎo)電極各一支,并在標準溫度((25℃)下以 c(KCl)=0.1mol?L-1和c(KCI)=0.02 mol?L-1氯化鉀溶液側(cè)定其電極常效.在標準沮度下c(KCl)=0.1 mol?L-1和c(KCI)=0.02mol?L-1溶液的電導(dǎo)率(y)分別為1.2880和0.2765S?m-1,若電極側(cè)得的電導(dǎo)值為S,則電極常數(shù)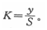
(3)操作步賺
①將電導(dǎo)電極引線接到電導(dǎo)儀相應(yīng)的接線柱上,接通電派,打開電源開關(guān)。
②按儀器說明書要求,調(diào)節(jié)儀器到工作狀態(tài)。
③將電導(dǎo)電極插人待側(cè)液,稍搖片刻,打開側(cè)A開關(guān),讀取電導(dǎo)讀數(shù)。
④側(cè)量待測液溫度。
⑤取出電極,用蒸餾水沖洗后以濾紙吸千,準備測定下一個樣品。
4、結(jié)果計算
依據(jù)電導(dǎo)讀數(shù)(S)及電數(shù)常數(shù)(K)和溫度系數(shù)(ft)可按下式計算出電導(dǎo)率(y):
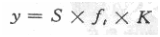
其總量最可由該地區(qū)的鹽分與電導(dǎo)率的數(shù)理統(tǒng)計關(guān)系方程式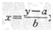
式中 y――土壤浸出液電導(dǎo)率,S?m-1,
x――土壤可溶性鹽總量,%;
a――截矩;
b――斜率。
5、注意事項
(1)側(cè)定電極常數(shù)時,應(yīng)選擇與樣品溶液濃度相近濃度的標準溶液,一般情況下,可選用c(KCI)=0.02 mol?L-1測定電導(dǎo)電極常數(shù)。
(2)測定高濃度樣品時,可選擇電極常數(shù)較高的鉑黑電極,在側(cè)定低濃度樣品時,因鉑黑對電解質(zhì)的吸附作用而使讀數(shù)不穩(wěn)定,應(yīng)選用不被鉑黑的光亮鉑電極。
(3)不同地區(qū)不同鹽分類型的鹽分電導(dǎo)曲線(y=bx+a)是不同的,必須用大量鹽分與電導(dǎo)進行統(tǒng)計求得。
三、質(zhì)量法
1、方法原理
質(zhì)量法一直被作為側(cè)定總鹽量的墓準方法。吸取水及提液,經(jīng)蒸干稱重得到烘干殘渣。烘干殘渣經(jīng)去除有機質(zhì)后,其量即作為可溶鹽總量。
2、儀器及設(shè)備
水浴鍋、電烘箱、分析天平。
3、操作步驟
(1)以大肚吸管吸取待測液((8.2.2)50mL~100 mL,放入已知質(zhì)量的燒杯中于水浴上蒸干。加人少量15%H202繼續(xù)在水浴上加熱以去除有機質(zhì),反復(fù)處理至殘渣發(fā)白,以完全去除有機質(zhì),蒸干。
(2)將燒杯放人1000C~105℃烘箱中烘干4h,移至干燥器中冷卻,用分析天平稱量。
(3)將燒杯繼續(xù)放入烘箱中烘2h,再稱重,直至恒重(二次量差小于0.0003g)。
4、結(jié)果計算
可溶鹽總量=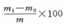
式中 可溶鹽總量――土城可溶鹽總質(zhì)量分數(shù),%;
m1――燒杯與鹽分質(zhì)量之和,g,
m2――空燒杯質(zhì)量,g;
m――吸取水浸提液體積相當(dāng)樣品質(zhì)量,g;
100――換算成每百克含量。
5、注意事項
(1)吸取水浸提液的數(shù)量應(yīng)視水浸提液中鹽分的數(shù)量而定,一般以保持燒杯中鹽分重量在0.02g~0.2g之間為佳。
(2)當(dāng)CaSO4?2HO或MgSO4?7HO的含量較高時,其結(jié)晶水需要在1800C才能去除。如CaCl2?6HO或MgCl2 ?6HO的含量高,由于其極易吸濕和潮解,可在燒杯中加入碳酸鈉溶液[p(Na2CO3)=20g?L-1],使產(chǎn)生鈣、鎂的碳酸鹽沉淀,然后再在105℃下供干、稱重。減去加入的Na2CO3量。
(3)當(dāng)鹽分中有鐵存在而出現(xiàn)黃色氧化鐵時,供干的鹽分也會出現(xiàn)黃色。
四、碳酸根、重碳酸根的測定(電位滴定法)
1、 方法選擇的依據(jù)
在傳統(tǒng)的分析中,通常將碳酸根與重碳酸根之和作為總堿度,但由于側(cè)定總堿度用的是酸堿滴定法,因而測定結(jié)果已包含了土壤中全部堿性鹽類所形成的堿度。土壤的總堿度是指土壤中的堿性鹽類水解所產(chǎn)生的堿度。土壤中的堿性鹽類除了碳酸鹽、重碳酸鹽外,尚有硼酸鹽和可洛性硅酸鹽等。但在一般情況下,后幾種鹽類在土壤中的含量很少。
傳統(tǒng)的側(cè)定CO32-和HCO3側(cè)定多采用雙指示劑中和法,當(dāng)用標準酸(硫酸或鹽酸)滴定時,反應(yīng)分兩步進行:
2Na2CO3+H2SO4→2NaHCO3+NaSO4
等當(dāng)點附近PH的突躍范圍為8.5~3.5,用四基橙指示劑檢出終點(pH3.8)。但該法滴定終點不靈敏,會產(chǎn)生較大誤差。尤其在測定PH較高的堿化土壤時,土壤溶液中棕、褐色的可溶性有機質(zhì)顏色易使滴定無法進行。用電位滴定則解決這個問題。
參考資料:土壤農(nóng)業(yè)化學(xué)分析方法







