首頁>技術中心>技術資訊>沉淀滴定法概述及銀量法確定終點的方法
沉淀滴定法概述及銀量法確定終點的方法
發布時間:2017-09-01
以沉淀反應為基礎的一種滴定分析法稱為沉淀滴定法。沉淀反應雖然很多,但能用于沉淀滴定的反應必須滿足下列條件:
①生成沉淀的溶解度必須要小,并且反應能定量進行。
②反應速率要快。
③能夠用適當的指示劑或其他方法確定滴定的終點。
④沉淀的吸附現象應不妨礙化學計量點的確定。
由于上述條件的限制,所以能夠用于沉淀滴定法的反應很少。目前應用較多的是生成難溶銀鹽的沉淀反應。例如:
Ag++C1一=AgCl↓
Ag++SCN一=AgSCN↓
利用生成難溶銀鹽的沉淀滴定法,稱為銀量法。銀量法主要用于測定Cl-、Br-、I-、Ag+及SCN-等。
在沉淀滴定法中,除了銀量法外,還有利用其他沉淀反應的方法。例如,K4[Fe(CN)6]與Zn2+,四苯硼鈉ENaB(C6H5)4]與K+等形成沉淀的反應,都可以用于沉淀滴定。
2K4[Fe(CN)6]+3Zn2+=K2Zn3[Fe(CN)6]2+6K+
NaB(C6H5)4+K+=KB(C6H5)4↓+Na+
銀量法確定終點的方法
沉淀滴定法可以用指示劑確定終點,根據確定終點所用指示劑的不同,銀量法可分為莫爾法、佛爾哈德法以及法揚司法。
莫爾法用鉻酸鉀作指示劑的銀量法稱為莫爾法。
存含右C1-的中件溶液中。加入K2Cr04指示劑,用AgNO3標準溶液滴定。由于AgCl的溶解度比Ag2CrO4小,根據分步沉淀原理,在用AgNO3滴定的過程中,溶液中首先析出AgCl沉淀。當Cl-定量沉淀后,過量一滴的AgN03與CrO2-4生成磚紅色的Ag2CrO4沉淀,即為滴定終點。滴定反應和指示劑的反應分別為:
Ag++Cl-?AgCl-↓(白色) Ksp=1.8×10-10
2Ag++CrO2-4?Ag2Cr04↓(磚紅色) Ksp=9.0×10-12
莫爾法中指示劑的用量和溶液的酸度是兩個主要問題。
(1)指示劑的用量
用AgN03標準溶液滴定Cl-時,在滴定終點時,應有:
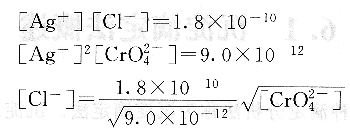
可見,滴定至終點時,溶液中剩余的Cl-濃度的大小與CrO2-4的濃度有關。若CrO2-4的濃度過大,則終點提前到達,溶液中剩余的Cl-濃度就大,從而使測定結果產生較大的負誤差。若CrO2-4的濃度過小,則終點推遲,消耗的Ag+又會增多,從而使測定結果產生較大的正誤差。因此為了獲得準確的測定結果,則必須嚴格控制CrO2-4的濃度。
反應到達化學計量點時:
![]()
此時所需的CrO2-4濃度為:
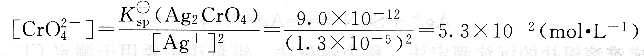
具體測定時,由于K2CrO4顯黃色,當濃度較高時顏色較深會影響終點的觀察,引入誤差,因此指示劑的濃度略低一些為好。一般滴定溶液中CrO2-4濃度約為5.0×10-3mol?L-1,較合適。
(2)溶液的酸度
滴定溶液應為中性或弱堿性(pH=6.5~10.5)。若溶液為酸性,則CrO2-4與H+發生反應:
2H++2CrO2-4?2HCrO-4?Cr202-4+H20
若溶液堿性太強,Ag+與OH-發生反應:
2Ag++20H一?2AgOH?Ag20+H20
因此莫爾法要求溶液的pH值范圍為6.5~10.5。當試液中有銨鹽時,要求溶液的酸度范圍更窄,pH為6.5~7.2,因為當溶液的pH值更高時,便有相當數量的NH3釋出,形成[Ag(NH3)2]+,使AgCl及Ag2Cr04溶解度增大,影響定量滴定。
凡能與Ag+生成沉淀的陰離子如PO3-4、AsO3-4、SO2-3、S2-、CO2-3、C2O2-4等,以及與CrO2-4一生成沉淀的陽離子,如Ba2+、Pb2+等,還有在中性或弱堿性溶液中易發生水解反應的離子如Fe3+、Al3+、Sn4+、Bi3+等,均干擾測定,應預先將其分離。
由于生成的AgCl沉淀易吸附溶液中的Cl-,使溶液中的C1一濃度降低,以致終點提前而引入誤差。因此,測定時必須劇烈搖動,使被吸附的C1-釋出。測定Br-時,AgBr吸附Br一比AgCl吸附Cl-嚴重,測定時更要注意劇烈搖動,否則會引入較大的誤差。
莫爾法不適宜測定I一和SCN一,因為AgI和AgSCN沉淀會更強烈地吸附-I和SCN一。此法也不能用于以NaCl標準溶液直接滴定Ag+。這是因為在Ag+試液中加入K2Cr04指示劑,將立即生成大量的Ag2Cr04沉淀,而且Ag2Cr04沉淀轉變為AgCl沉淀的速率甚慢,使測定無法進行。
佛爾哈德法
佛爾哈德法是以鐵銨礬[NH4Fe(SO4)2?12H20]作指示劑的銀量法,包括直接滴定法和返滴定法。
(1)直接滴定法測定Ag+
在含有Ag+的酸性溶液中,以鐵銨礬作指示劑,用NH4SCN(或KSCN)標準溶液滴定。溶液中首先析出AgSCN沉淀,當Ag+定量沉淀后,過量的SCN一與Fe3+生成紅色配合物,即為終點。滴定反應和指示劑反應如下:
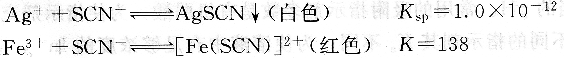
滴定時,溶液的酸度一般控制在0.1~lmol?L一1之間。酸度過低,Fe3+易水解。Fe3+濃度過大,它的黃色干擾終點的觀察。綜合這兩方面的因素,終點時Fe3+濃度一般控制在0.015mol?L-1。
在滴定過程中,不斷有AgSCN沉淀生成,由于它有較強烈的吸附作用,所以有部分Ag+被吸附于其表面,因此往往產生終點出現過早的情況,使結果偏低。滴定時,必須充分搖動溶液,使被吸附的Ag+及時地釋放出來。
(2)返滴定法測定鹵素離子
在含有鹵素離子的試液中,首先加入一定量過量的AgN03標準溶液,使之與鹵素離子充分反應,然后以鐵銨礬為指示劑,用NH4SCN標準溶液返滴定過量的AgN03。
用返滴定法測定C1-時,由于AgCl的溶解度比AgSCN大,故終點后,稍過量的SCN一將與AgCl發生沉淀轉化反應,使AgCl轉化為溶解度更小的AgSCN:
AgCI+SCN一?AgSCN↓+Cl一
所以溶液中出現了紅色之后,隨著不斷地搖動溶液,紅色又逐漸消失,不僅多消耗一部分NH4SCN標準溶液,同時也使終點不易判斷。為了避免上述誤差,通常采取下列措施:
①將溶液煮沸,使AgCl沉淀凝聚,經過濾后用NH4 SCN標準溶液返滴定濾液中過量的AgN03。
②在Cl一溶液中加入過量的AgN03,充分反應后加入有機溶劑如硝基苯或1,2-二氯乙烷1~2mL,以包裹沉淀,可阻止轉化反應發生。此法簡便,但因硝基苯有毒性,操作時應多加小心。
用返滴定法測定Br一、I一時,由于AgBr及AgI的溶解度均比AgSCN小,不發生上述的轉化反應。但在測定I-時,指示劑必須在加入過量的AgN03后加入,否則Fe3+將氧化I-為I2,影響分析結果的準確度。
佛爾哈德法的最大優點是滴定在酸性介質中進行,一般酸度大于0.3tool?L-1。在此酸度下,許多酸根離子如PO3-4、AsO3-4、Cr2 O2-7、C2 O2-4、CO2-3等不干擾滴定;但一些強氧化劑、氮的低價氧化物以及銅鹽、汞鹽等能與SCN-反應,干擾測定,必須預先除去。
法揚司法
用吸附指示劑確定終點的銀量法,稱為法揚司法。吸附指示劑是一類有色的有機化合物,當它被吸附在膠體微粒表面之后,可能是由于形成某種化合物而導致指示劑分子結構的變化,因而引起顏色的變化。
例如熒光黃指示劑,它是一種有機弱酸,用HFI表示,在溶液中可解離為陰離子FI一,呈黃綠色。當用AgN03標準溶液滴定CI-時,加入熒光黃指示劑,在化學計量點之前,溶液中Cl-過量,AgCl沉淀表面膠體微粒吸附Cl-而帶負電荷(AgCl.C1-),不吸附指示劑陰離子FI-,溶液呈黃綠色。滴定到化學計量點之后,稍過量的AgN03可使AgCl沉淀表面膠體微粒吸附Ag+而帶正電荷(Agc卜Ag+)。這時,帶正電荷的膠體微粒吸附FI-,形成表面化合物(AgCl?Ag+?FI一),使整個溶液由黃綠色變成淡紅色,以指示終點的到達。
為使終點時指示劑顏色變化明顯,使用吸附指示劑應注意以下幾點:
①控制適當的pH。常用的吸附指示劑多數是有機弱酸,為使指示劑充分解離,必須控制適當的pH。不同的指示劑其Ka不同,為使溶液中有足夠濃度的In一,應使溶液的pH>pKa,但過高的pH會使Ag+形成Ag20沉淀,因此須控制適當的pH范圍。
②增大沉淀的表面積。吸附指示劑的變色反應發生在沉淀表面,表面積越大,終點時顏色變化越明顯,為此可加入糊精、淀粉等膠體保護劑,使沉淀保持膠體狀態,以增大沉淀的表面積。
③應避免陽光直接照射,否則滴定過程中鹵化銀會分解。
④沉淀時膠體微粒對指示劑的吸附能力應稍低于對被測離子的吸附能力,否則化學計量點之前,指示劑離子就進入吸附層使終點提前。鹵化銀對幾種常用吸附指示劑和鹵素離子的吸附能力順序為:
I->SCN>Br一>曙紅>C1一>熒光黃
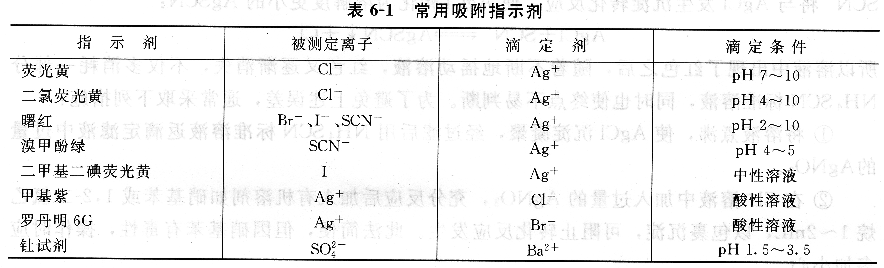
常用吸附指示劑見.表6―1。
參考資料:分析化學







