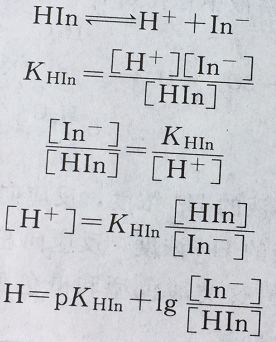酸堿滴定酸堿指示劑
發布時間:2017-09-01
酸堿滴定分析中判斷終點的方法主要有兩種:指示劑法和電位滴定法。指示劑法是利用指示劑在一定條件時變色來指示終點;電位滴定法則是通過測量兩個電極的電位差,根據電位差的突變來確定終點。
這里僅討論指示劑法。
酸堿指示劑的作用原理:
酸堿指示劑一般為弱的有機酸或有機堿,它們的共軛酸堿對具有不同的結構,因而呈現不同的顏色。當溶液pH值改變時,指示劑失去質子由酸型轉變為堿型,或得到質子由堿型轉變為酸型,結構發生變化,從而引起顏色的變化。下面以甲基橙和酚酞為例來說明。
甲基橙是一種弱的有機堿,在溶液中存在如下平衡:
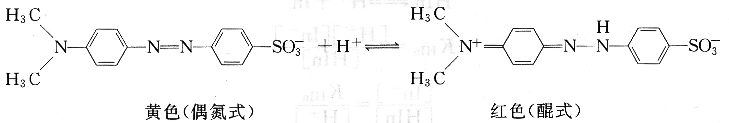
由平衡關系可以看出,增大溶液的H+濃度,反應向右進行,甲基橙主要以醌式(酸色型)存在,溶液呈紅色;降低溶液的H+濃度,反應向左進行,甲基橙主要以偶氮式(堿色型)存在,溶液呈黃色。像甲基橙這類酸色型和堿色型均有顏色的指示劑,稱為雙色指示劑。
又如酚酞,它是一種弱的有機酸,屬單色指示劑,在溶液中有如下平衡:
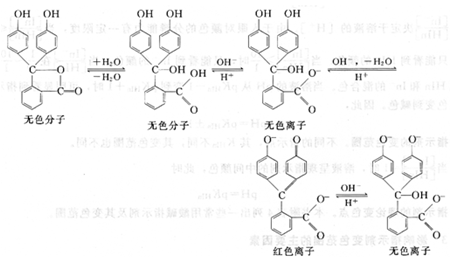
酚酞為無色二元弱酸,當溶液的pH逐漸升高時,酚酞給出一個質子H+,形成無色的離子;然后再給出第二個質子H+并發生結構的改變,成為具有共軛體系醌式結構,呈紅色,第二步離解過程的pKa2=9.1。當堿性進一步加強時,醌式結構轉變為無色羧酸鹽式離子。酚酞結構變化的過程也可簡單表示為:
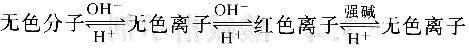
上式表明,這個轉變過程是可逆的。當溶液pH降低(H+濃度增大)時,平衡向左移動,酚酞又變成無色的分子。當pH值升高到一定數值后成紅色,在濃的強堿溶液中酚酞又變成無色。反之亦然。
指示劑的變色范圍
指示劑在不同pH值的溶液中,顯示不同的顏色。但是否溶液pH稍有改變時,我們就能看到它的顏色變化呢?事實并不是這樣,必須使溶液的pH值改變到一定程度,才能看得出指示劑的顏色變化。也就是說,引起指示劑變色的pH值是有一定范圍的,只有在超過這個范圍我們才能明顯地觀察到指示劑顏色的變化。
若以HIn表示一種弱酸型指示劑,In-為其共軛堿,在溶液中有如下平衡: