金屬離子指示劑的作用
發布時間:2017-09-01
金屬指示劑是一些有機配位劑,可與金屬離子生成有色配合物,其有色配合物的顏色與游離指示劑的顏色不同,從而可以用來指示滴定過程中金屬離子濃度的變化情況,因而稱為金屬離子指示劑,簡稱金屬指示劑。以鉻黑T(EBT)為例說明金屬指示劑的作用原理。
鉻黑T在pH 8~11時呈現藍色,它與Ca2+、Mg2+、Zn2+等金屬離子形成的配合物呈酒紅色。EDTA滴定這些金屬離子時,加入鉻黑T指示劑,滴定前它與少量金屬離子形成酒紅色配合物,而大多數金屬離子處于游離狀態。隨著EDTA的不斷滴入,游離金屬離子逐步被配位形成配合物M-EDTA。當游離的金屬離子幾乎完全配位后,繼續滴加EDTA時,由于EDTA與金屬離子形成的配合物(M-EDTA)的條件穩定常數大于鉻黑T與金屬離子形成的配合物(M-鉻黑T)的條件穩定常數,因此,EDTA奪取M-鉻黑T中的金屬離子,從而將指示劑釋放出來,溶液顯示出游離鉻黑T的藍色,指示滴定終點的到達。其反應方程式如下:
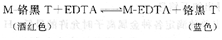
金屬離子指示劑應具備的條件。從以上的討論可知,作為金屬指示劑應具備以下條件:
①在滴定的pH范圍內,指示劑與金屬離子形成的配合物的顏色必須與指示劑本身的顏色有明顯的差別。
②指示劑與金屬離子形成的配合物的穩定性要適當。它既要有一定的穩定性,但是又要比金屬離子與EDTA形成的配合物的穩定性要小。如果指示劑與金屬離子形成的配合物的穩定性太低,就會導致終點提前,而且變色不敏銳;相反,如果穩定性太高,又會使終點拖后,而且有可能雖加入過量的EDTA也不能奪走其中的金屬離子,得不到滴定終點,這種現象稱為指示劑的封閉。通常可采用加入適當的掩蔽劑來消除指示劑的封閉現象。例如,
在pH=10,以EBT為指示劑滴定Ca2+、Mg2+總量時,A13+、Fe3+、Cu3+、Ni2+、Co2+會封閉指示劑,使終點無法確定。可以加入掩蔽劑,使這些干擾離子生成更穩定的配合物,從而不再與指示劑作用,如加入三乙醇胺消除Al抖、Fe。+對EBT的封閉,加入KCN掩蔽Cu2+、Ni2+、C02+。
③指示劑與金屬離子的反應必須迅速、靈敏,具有良好的可逆性。
④指示劑與金屬離子形成的配合物應易溶于水。如果指示劑與金屬離子形成的配合物溶解度很小,將使EDTA與指示劑的置換速率緩慢,終點拉長,這種現象稱為指示劑的僵化。解決的方法是可以加入有機溶劑或加熱,以增大其溶解度。例如,用PAN作指示劑時常加入乙醇或加熱。
由于金屬指示劑大多數是具有若干雙鍵的有色化合物,易受日光、氧化劑、空氣等的作用而分解,有些在水中不穩定,有些日久則變質。因此,這些指示劑可以用中性鹽稀釋后配成固體指示劑使用,可在指示劑溶液中加入可以防止變質的試劑。如鉻黑T常用氯化鈉固體作稀釋劑配制。一般金屬指示劑都不宜久放,最好用時現配。
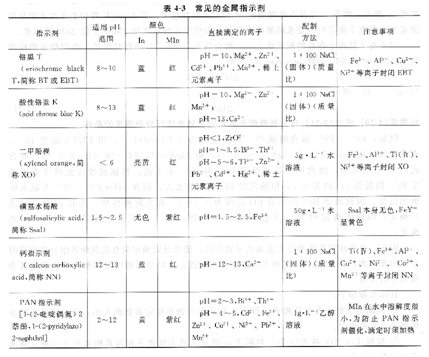
2、常用的金屬離子指示劑
常用的金屬指示劑列于表4-3。
參考資料:分析化學







