沉淀的類型和沉淀的形成
發布時間:2017-09-01
沉淀的類型:
沉淀按其物理性質的不同分為兩類:一類是晶形沉淀;另一類是無定形沉淀。無定形沉淀又稱為非晶形沉淀或膠狀沉淀。BaSO4是典型的晶形沉淀,Fe203?H2O是典型的無定形沉淀。AgCl是一種凝乳狀沉淀,按其性質來說,介于兩者之間。它們的最大差別是沉淀顆粒的大小不同。顆粒最大的是晶形沉淀,其直徑為O.1~1μm;無定形沉淀的顆粒很小,直徑一般小于0.02μm;凝乳狀沉淀的顆粒大小介于兩者之間。從整個沉淀外形看,由于晶形沉淀是由較大的沉淀顆粒組成的,內部排列較規則,結構緊密,所以整個沉淀所占的體積比較小,極易沉降于容器的底部。無定形沉淀是由許多疏松聚集在一起的微小沉淀顆粒組成的,沉淀顆粒的排列雜亂無章,其中又包含大量數目不定的水分子,所以是疏松的絮狀沉淀,整個沉淀體積龐大,不像晶形沉淀那樣很好地沉降在容器的底部。
在重量分析中,最好獲得晶形沉淀。晶形沉淀有粗晶形沉淀和細晶形沉淀之分,如MgNH4 P04是粗晶形沉淀,BaSO4為細晶形沉淀。
沉淀的形成:
沉淀的形成一般要經過晶核形成和晶核長大兩個過程。將沉淀劑加入試液后,當形成沉淀的離子(構晶離子)濃度冪的乘積大于該條件下此沉淀的溶度積時,離子通過相互碰撞而聚集成微小的晶核,當晶核形成后,溶液中的構晶離子向晶核表面擴散,并沉積在晶核上,晶核就逐漸長大成沉淀顆粒。這種由離子形成晶核,再進一步聚集成沉淀顆粒的速率稱為聚集速率。在聚集的同時,構晶離子在一定晶格中定向排列的速率稱為定向速率。生成沉淀的類型是由聚集速率和定向速率的相對大小所決定的。如果聚集速率大,定向速率小,離子能很快地聚集生成沉淀顆粒,但卻來不及進行晶格排列,則得到無定形沉淀。反之,離子較緩慢地聚集成沉淀,有足夠時間進行晶格排列,則得到晶形沉淀。
聚集速率主要由沉淀時的條件所決定,其中最重要的是溶液中生成沉淀物質的相對過飽和度。槐氏(von Weimarn)在深入研究影響沉淀顆粒大小的因素基礎上,提出晶體顆粒形成速率與過飽和度關系的經驗公式:
υ=K(Q―s)/s (7―10)
式中,υ為形成沉淀的初始速率(聚集速率);Q為加入沉淀劑瞬間沉淀物質的濃度;s為開始沉淀時沉淀物質的溶解度;Q―s為沉淀開始瞬間的過飽和度;(Q―s)/s為沉淀開始瞬間的相對過飽和度;K為比例常數,它與沉淀的性質、溫度、溶液中存在的其他物質等因素有關。
從式(7―10)可清楚看出,溶液的相對過飽和度大,聚集速率大,易生成無定形沉淀;相對過飽和度小,則聚集速率小,有利于生成晶形沉淀。若要聚集速率小,必須使相對過飽和度小,那么就要求沉淀的溶解度s大,加入沉淀劑瞬間沉淀物質的濃度不太大,就可能獲得晶形沉淀。反之,若沉淀的溶解度很小,瞬間生成沉淀物質的濃度又很大,則形成無定形沉淀。例如]3aSO4通常情況下為晶形沉淀,但在濃溶液(如0.75~3mol?L-1)中進行沉淀時,也會形成無定形沉淀。
定向速率主要決定于沉淀物質的本性。一般極性強的鹽類,如MgNH4PO4?6H2 O、BaSO4、CaC2O4等,具有較大的定向速率,易形成晶形沉淀。而氫氧化物具有較小的定向速率,因此其沉淀一般為非晶形。特別是高價金屬離子的氫氧化物,如Fe(OH)3、Al(OH)3等,結合的OH-愈多,定向排列愈困難,定向速率愈小。且這類沉淀的溶解度極小,聚集速率很大,加人沉淀劑瞬間形成大量晶核,使水合離子來不及脫水,便帶著水分子進入晶核,晶核又進一步聚集起來,因而一般都形成質地疏松、體積龐大、含有大量水分的非晶形膠狀沉淀。二價金屬離子(如Mg2+、Zn2+、Cd2+等離子)的氫氧化物,如果條件適當,可以形成晶形沉淀。金屬的硫化物一般都比其氫氧化物溶解度小,是非晶形或膠狀沉淀。
由此可見,沉淀的類型,不僅決定于沉淀的本性,也決定于沉淀進行時的條件,若改變沉淀條件,也可能改變沉淀的類型。
影響沉淀純度的主要因素:
在重量分析中,要求獲得的沉淀是純凈的。但是,沉淀是從溶液中析出的,總會或多或少地夾雜溶液中的其他組分。因此,必須了解沉淀生成過程中混入雜質的各種原因,找出減少雜質混入的方法,以獲得符合重量分析要求的沉淀。
共沉淀現象:
當一種沉淀從溶液中析出時,溶液中的某些可溶性雜質會被沉淀帶下來而混雜于沉淀中,這種現象稱為共沉淀。
(1)表面吸附在沉淀中,構晶離子按一定的規律排列,在晶體內部處于電荷平衡狀態;但在晶體表面,離子的電荷則不完全平衡,因而會導致沉淀表面吸附雜質。這些抗衡離子中,通常有少部分被Ag+較強烈吸引,也處于吸附層中,第一吸附層和第二吸附層共同組成沉淀表面的雙電層,從而使電荷達到平衡。雙電層能隨沉淀一起沉降,從而沾污沉淀。這種由于沉淀的表面吸附所引起的雜質共沉淀現象叫表面吸附共沉淀。
圖7―1是AgCl沉淀表面吸附雜質的示意圖。
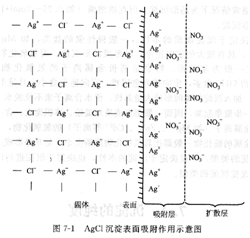
沉淀表面吸附離子具有選擇性,一般情況下,由于沉淀劑過量,吸附層首先吸附的是構晶離子, 此外,沉淀表面吸附雜質的量還與下列因素有關。
①與沉淀的總表面積有關 同量的沉淀,顆粒愈小,表面積愈大,吸附的雜質量也就愈多。無定形沉淀的顆粒很小,比表面很大,所以表面吸附現象特別嚴重。
②與溶液中雜質的濃度有關溶液中雜質離子濃度越大,被沉淀吸附的量越多。
③與溶液的溫度有關 因為吸附作用是一個放熱的過程,因此,溶液溫度升高時,吸附雜質的量將減少。
(2)生成混晶
每種晶形沉淀,都有其一定的晶體結構。如果試液中雜質與沉淀具有相的晶格,或雜質離子與構晶離子具有相同的電荷和相近的離子半徑,雜質將進入晶格排列中形成}昆晶。由于雜質是進入沉淀內部的,通常用洗滌或陳化的方法難以除去。為避免混晶的生成,最好事先將這類雜質分離除去。
(3)吸留和包藏
在沉淀過程中,如果沉淀生成太快,則表面吸附的雜質離子來不及離開沉淀表面就被沉積上來的離子所覆蓋,這樣雜質就被包藏在沉淀內部,引起共沉淀,這種現象稱為吸留。吸留引起共沉淀的程度,也符合吸附規律。有時母液也可能被包藏在沉淀之中,引起共沉淀。
這類共沉淀不能用洗滌的方法將雜質除去,可以采用改變沉淀條件、陳化或重結晶的方法來避免。
當沉淀析出后,在放置過程中,溶液中某些雜質離子可能慢慢沉淀在原沉淀上面,這種現象稱為后沉淀。這種情況大多發生在該組分形成的穩定的過飽和溶液中。
后沉淀所引入的雜質量比共沉淀要多,且隨著沉淀放置時間的延長而增多。因此為防止后沉淀現象的發生,某些沉淀的陳化時間不宜過久。
提高沉淀純度的措施:
由于共沉淀及后沉淀現象,使沉淀被沾污而不純凈。為了提高沉淀的純度,減小沾污,可采用下列措施:
① 擇適當的分析步驟 。
②選擇合適的沉淀劑。
③降低易被吸附雜質離子的濃度。
④選擇適當的沉淀條件針對不同類型的沉淀,選用適當的沉淀條件。
⑤再沉淀將已得到的沉淀過濾后溶解,再進行第二次沉淀。第二次沉淀時,溶液中雜質的量大為降低,共沉淀或后沉淀現象自然減少。這種方法對于除去吸留和包藏的雜質效果很好。有時采用上述措施后,沉淀的純度提高仍然不明顯,則可對沉淀中的雜質進行測定,再對分析結果加以校正。
在重量分析中,共沉淀或后沉淀現象對分析結果的影響程度,隨具體情況的不同而不同。如果沉淀中夾有Bacl2,最后按BaSO4計算,必然引起負誤差。如果沉淀吸附的是揮發性的鹽類,灼燒后能完全除去,則將不引起誤差。
參考資料:分析化學







