配位滴定法的滴定曲線
發布時間:2017-09-01
在EDTA配位滴定中,隨著配位劑EDTA的不斷加入,被滴定的金屬離子濃度[M]不斷減小,達到化學計量點附近時,溶液的pM發生突躍。因此,討論滴定過程中金屬離子濃度的變化規律(即滴定曲線)及影響pM突躍的因素是極其重要的。
繪制滴定曲線時,必須要計算隨著EDTA加入量的不同,pM相應的變化情況。在配位滴定法中,除了主反應外,還有涉及EDTA、金屬離子M和產物MY的各種副反應。
對于不易水解且不與其他配位劑配位的金屬離子,只需考慮EDTA的酸效應,引入aY(H)對KMY進行修正;對于易水解的金屬離子,還應考慮水解效應,引入aY(H)和aM(oH)對KMY修正;對于易水解且與輔助配位劑配位的金屬離子,則應考慮aY(H)和aM修正KMY。然后利用條件穩定常數計算化學計量點和化學計量點后被滴定金屬離子的濃度,并求得pM,從而根據pM隨著滴定劑EDTA的變化關系繪制滴定曲線。
需要說明的是,配位滴定的滴定曲線僅能說明在不同pH條件下,金屬離子濃度(pM)在滴定過程中的變化情況,而用于選擇指示劑的實用性不大。
1、單一離子體系準確滴定的條件
在配位滴定法中,通常使用金屬離子指示劑來指示終點,由于人眼判斷顏色的局限性,目測終點與化學計量點pM的差值ApM一般為±(O.2~0.5)。若允許相對誤差為0.1%,金屬離子的分析濃度為c,根據終點誤差公式可推導出
lgcK’MY≥6 (4―17a)
通常將式(4―17a)作為能否用配位滴定法準確滴定單一金屬離子的判別式。若能滿足該條件,則可得到相對誤差小于或等于O.1%的分析結果。若金屬離子的分析濃度為
O.01mool?L-1,代入式(4―17a)可得
LgK’MY≥8 (4―17b)
2、配位滴定中酸度的控制和酸效應曲線
在配位滴定中,假設配位反應中除了EDTA的酸效應和M的水解效應外,沒有其他副反應,則溶液酸度的控制是由EDTA的酸效應和金屬離子的羥基配位效應決定的。根據酸效應可以確定滴定時允許的最低pH值(最高酸度),根據羥基配位效應可以估算出滴定時允許的最高pH值(最低酸度)。從而得出滴定的適宜pH范圍。
最高酸度(最低pH)的確定,將式(4―16)和式(4―17a)結合可得:
lgc+lgKMY―lgaY(H)≥6
1gdY(H)≤1gc+1gKMY一6 (4―18)
由式(4―18)可計算出lgaY(H),再查表4―2,可求得配位滴定允許的最低pH(pHmin)。
由式(4―18)可知,不同金屬離子由于其lgKMY不同,滴定時允許的最低pH值也不同。
將金屬離子的lgKMY值與最低pH[或對應的lgaY(H)與最低pH]繪制成曲線,稱為EDTA的酸效應曲線或林邦(Ringbon)曲線,如圖4―6所示。圖中金屬離子位置所對應的pH值,就是滴定該金屬離子(c=O.01mool?L-1)時所允許的最低pH值。
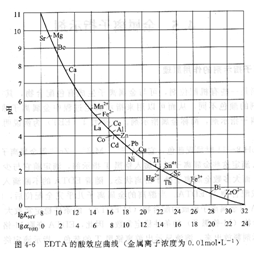
從林邦曲線上可以得出如下信息:
① 曲線上可以查出單獨滴定各種金屬離子時允許的最低pH值。例如FeY-配合物的lgKFeY一=25.1,查圖4―6得到pH>l,即在強酸性溶液中滴定;而CaY2-的滴定條件須在pH≈7.8的弱堿性溶液中滴定。
②通過曲線可知在一定范圍內哪些離子可以被滴定,哪些離子對滴定有干擾。曲線下方的離子干擾曲線上方離子的滴定。
③從曲線還可以看出,利用控制酸度的方法,在同一溶液中可以連續滴定哪幾種離子。
在滿足滴定所允許的最低pH值的條件下,增大溶液的pH值,lgay(H)減小,則lgK’MY增大,配位反應的完全程度也增大。但是若溶液的pH太高,金屬離子尤其是高氧化值的金屬離子易發生水解或形成羥基配合物,從而影響配位反應的進行。因此,還應考慮不使金屬離子水解或發生羥基配位反應的pH條件。一般粗略計算時,可直接利用金屬離子氫氧化物的溶度積常數求得。
參考資料:分析化學







